В насыщенных растворах малорастворимых солей (все соли являются сильными электролитами), кристаллы которых построены из ионов, устанавливается равновесие между гидратированными ионами в растворе и ионами в кристаллах (твердая фаза).
Насыщенный раствор получается тогда, когда дальнейшее растворение данного вещества в растворе прекращается. В насыщенном растворе концентрация этого вещества максимальна при данных условиях. Концентрация вещества в его насыщенном растворе называется его растворимостью Ср.
Растворимость выражается в моль/л или г/л. Так, в насыщенном растворе электролита AnBm, находящегося в равновесии с его твердой фазой, устанавливается следующее равновесие:
| растворение | ||
 AnBm(тв) AnBm(тв) | nAm++ mBn-. | |
| твердая фаза | кристаллизация | насыщенный раствор |
Поскольку в растворах сильных электролитов состояние ионов определяется их активностями, то константа равновесия этого процесса выразится следующим уравнением:
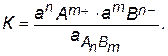
Прямой и обратный процессы являются гетерогенными, так как протекают на поверхности осадка. Знаменатель этой дроби, т.е. активность твердого вещества, есть величина постоянная, поэтому произведение К . а АnBm тоже величина постоянная при данной температуре. Отсюда следует, что произведение активностей ионов тоже представляет собой постоянную величину, называемую произведением растворимости (ПР):
ПР = 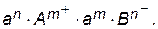 | (6.3) |
 2015-10-22
2015-10-22 807
807








