Самопроизвольное протекание окислительно-восстановительной реакции, как и любой другой реакции, сопровождается уменьшением энергии Гиббса. Разность стандартных электродных потенциалов окислителя и восстановителя (∆Eо) связана со стандартной энергией Гиббса (∆G о) соотношением:
∆G о =nF∆E о, (7.3)
где n – число принятых (или отданных) в ходе реакции электронов; F – число Фарадея (96500 Кл); ∆E о – изменение стандартного окислительно-восстановительного потенциала в ходе процесса, ∆E о =Е оокис.– Е овосст. .
Из уравнения (7.3) следует, что возможность самопроизвольного протекания окислительно-восстановительной реакции определяется значением ∆E о.
Если изменение стандартного окислительно-восстановительного потенциала имеет положительное значение (∆Е о= Е оокис.– Е овосст.>0 ), то ∆G < 0 и реакция может протекать в прямом направлении.
Если ∆E <0, то ∆G >0 и прямая реакция в данных условиях невозможна, а возможна лишь обратная реакция.
В качестве примера рассмотрим реакцию:
SnCl2 + 2FeCl3  SnCl4 + 2FeCl2.
SnCl4 + 2FeCl2.
Состоянию олова и железа в этой реакции соответствуют окислительно-восстановительные пары Sn4+/Sn2+ и Fe3+/Fe2+, значения E одля которых равны +0,15 В и +0,77 В соответственно (см. прил., табл. 11).
В молекуле FeCl3 атом железа находится в высшей степени окисления и, следовательно, способен быть только окислителем. Атом олова в молекуле SnCl2 имеет промежуточную степень окисления и в присутствии сильного окислителя (FeCl3) является восстановителем.
Разность ∆Е о= Е оокис.– Е 0восcт. = 0,77–0,15=0,62 В величина положительная, следовательно, в стандартных условиях данная реакция будет осуществляться в прямом направлении. Соотношение в величинах Е оокис. и Е овосcт. определяет и глубину протекания процесса: чем больше разность этих величин, тем полнее превращение.
Часто реакции окисления-восстановления не доходят до конца, и в системе устанавливается равновесие, характеризуемое константой равновесия, которая может быть вычислена по уравнению
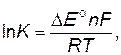
где К – константа равновесия; ∆E о= Е оокис.– Е овосст. – изменение стандартного окислительно-восстановительного потенциала; n – число отданных (принятых) электронов в ходе реакции; F – число Фарадея, равное 96500 Кл; R – газовая постоянная, равная 8,31Дж/моль·К; T – абсолютная температура, К.
 2015-10-22
2015-10-22 5827
5827
