Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной связью.
Для описания и расчета ковалентной химической связи (КХС) используют два метода – метод валентных связей и метод молекулярных орбиталей.
Основные положения метода валентных связей (ВС) базируются на квантово-механической теории строения атома разработаны в 1928 г (В. Гейтлер, Ф. Лондон, позже Л. Полинг, Дж. Слейтер):
1. В образовании химической связи участвуют только электроны внешнего электронного уровня атома (валентные электроны).
2. Химическая связь образуется двумя электронами разных атомов с антипараллельными спинами. При этом электронные облака перекрываются и между атомами появляется область повышенной электронной плотности, которая обусловливает связь между ядрами атомов.
3. Химическая связь осуществляется в направлении максимального перекрывания атомных электронных орбиталей.
4. Наибольшей прочностью обладает связь, которая является результатом наибольшего перекрывания электронных орбиталей.
5. При образовании молекул электронная структура (кроме внешней электронной оболочки) и химическая индивидуальность атома в основном сохраняются.
Метод валентных связей обладает многими достоинствами, позволяет предсказать свойства многих молекул: полярность, энергию и длину связей, пространственную конфигурацию и др. Однако, свойства некоторых частиц (Н2+, Не2+, О2-, свободные радикалы, имеющие неспаренные электроны) невозможно объяснить на основании положения этого метода. О наличии неспаренных электронов можно судить по магнитным свойствам веществ. Вещества, имеющие неспаренные электроны втягиваются в магнитное поле, т.е. являются парамегнитными. Вещества, не имеющие неспаренных электронов выталкиваются из магнитного поля, т.е. диамагнитны. Согласно методу валентных связей молекула кислорода не имеет неспаренных электронов, однако кислород парамгнитен.
Образование КХС возможно по двум механизмам: обменному и донорно-акцепторному.
Обменный механизм реализуется за счет поделенной электронной пары, т.е. пары электронов, каждый из которых принадлежал ранее разным атомам. Например, схема образования молекулы F2 по этому механизму (рис.1, рис.2):

Рис.1. Образование КХС на примере электронно-графических формул атомов фтора.

Рис. 2. Схема образования КХС в молекуле F2
Из рис. 2 видно, что химическая связь образована за счет перекрывания электронных облаков по линии, связывающей центры атомов. Такая связь называется сигма-связью и обозначается буквой σ. Такая связь образуется при перекрывании классических облаков
(s ─ s, p ─ p, p ─ s, d ─ d, s ─ d, p ─ d и др.), а также гибридных облаков разных форм. Расчеты показывают, что степень перекрывания электронных облаков, а значит и прочность соответствующей связи, увеличивается в ряду s ─ s < s ─ р < p ─ p (рис. 3). При образовании связей р-электронами возможно боковое перекрывание электронных облаков. В этом случае максимальная электронная плотность располагается по обе стороны от линии, соединяющей центры атомов. Такая связь называется пи-связью (π – связь). Такой вид связи возникает и за счет перекрывания d─ и р-электронных облаков или d – облаков (рис.4).

Рис. 3. примеры σ –связей

Рис. 4. Примеры π-связей
Донорно-акцепторный механизм предполагает образование КХС за счет неподелённой электронной пары одного атома и свободной электронной орбитали другого атома. Проследить этот механизм можно на примере образования хлорида метиламмония
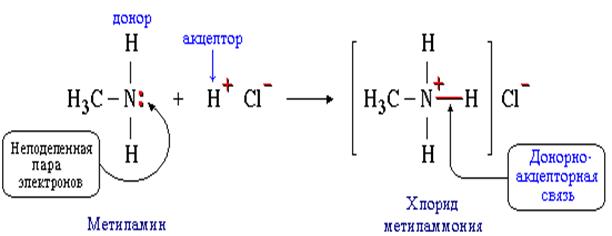
Здесь донором является метиламин, акцептором – катион водорода в молекуле хлороводорода.
 2015-10-22
2015-10-22 1482
1482
