1. Момент импульса электрона
L = m Vnrn= 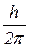 n,
n,
где m – масса электрона; Vn – скорость электрона на n -й орбите; rn – радиус
n -й орбиты; h – постоянная Планка (h = 6,626176 × 10–34 Дж × с); n – главное квантовое число (n = 0, 1, 2,…).
2. Радиус боровской орбиты
rn = a0 n2,
где a0 = 52,9 пм – радиус первой боровской орбиты.
3. Энергия электрона в атоме водорода
En= –Ei/n2,
где Ei = 13,6 эВ – энергия ионизации водорода.
4. Энергия, излучаемая или поглощаемая атомом водорода
ε = En – Ek = Ei(1/k2 – 1/n2),
где n и k – квантовые числа, соответствующие энергетическим уровням, между которыми совершается переход электрона в атоме.
5. Частота, соответствующая линиям водородного спектра,
ν = с/λ = R c (1/k2 – 1/n2),
где с – скорость света в пустоте; R – постоянная Ридберга (R = 1,097 × 107 м–1); k и n – номера орбит.
6. Частота для водородоподобных ионов
ν = с/λ = R c Z2(1/k2 - 1/n2),
где Z – порядковый номер элемента.
7. Формула Мозли (частота рентгеновских характеристических лучей)
ν = с/λ = R c (Z – b)2 (1/k2 – 1/n2),
где Z – порядковый номер элемента, из которого сделан антикатод; b – «постоянная экранирования».
 2015-10-22
2015-10-22 607
607








