Обозначение всех физических величин такое же, как в п. 3.1.
В исследуемой системе a = b.
Равенство молярных концентраций эфира и гидроксида натрия доказано, если добавленная в систему серная кислота не израсходована на избыток гидроксида натрия (выполнено соотношение количеств кислоты и основания при t = ¥).
Рассчитывают молярные концентрации всех участников реакции (таблица 7.3), исходя из следующих соотношений:
|
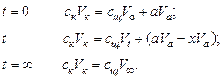
Если при t = ¥ равенство количеств кислоты и гидроксида натрия в титранте не наблюдается, то возможны две причины:
1) исходная система приготовлена неправильно, один из продуктов реакции взят в избытке. В этом случае математическую обработку результатов исследования проводят согласно п. 3;
2) реакция не прошла до конца.
Изображают зависимости молярных концентраций участников реакции от времени.
Таблица 7.3 – Молярные концентрации сложного эфира, щелочи,
ацетата натрия и этилового спирта
| Вре-мя | Объем титранта | Молярные концентрации с (Х), моль/дм3 | Константа скорости реакции, с-1×моль-1×дм3 | |||||
| t, с | Vщ, см3 | R1COOR2 | NaOH | R1COONa | R2OH | k | 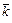
| 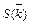
|
 2015-10-22
2015-10-22 286
286








