Тема: МОЛЕКУЛЯРНАЯ ФИЗИКА. Основы МКТ.
План лекції №6:
МОЛЕКУЛЯРНАЯ ФИЗИКА
4. Молекулярная физика
Молекулярно-кинетические представления
Уравнение состояния идеального газа
Закон Дальтона для смеси газов
Задания и вопросы для самоконтроля

4. МОЛЕКУЛЯРНАЯ ФИЗИКА Молекулярная физика и термодинамика - разделы физики, изучающие макроскопические процессы в телах, состоящих из огромного числа частиц - атомов и молекул. У них общий объект изучения, но различные методы. Молекулярная физика изучает свойства тел на основе рассмотрения их молекулярного строения. Термодинамика не обращается к атомно-молекулярному строению вещества, а исходит из нескольких фундаментальных законов (называемых началами термодинамики), которые получены путем обобщения большого количества опытных фактов. 4.1. Молекулярно-кинетические представления Молекулярная физика изучает строение вещества, исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении. Идея об атомном строении вещества высказана впервые древнегреческим философом Демокритом (460 - 370 гг. до н. э.). Во время прогулки по берегу моря он наблюдал увлажнение одежды и пришел к выводу, что тела состоят из мельчайших неделимых частиц - атомов. В течение многих веков учение об атомах запрещалось церковью. Вновь атомистика возрождается лишь в XVII в. в трудах М.В. Ломоносова. Строгое развитие эта наука получила в XIX в. и связана с работами Клаузиуса, Максвелла, Больцмана и др. Для построения молекулярно-кинетической теории надо знать размеры атомов. Оценки показывают, что размеры атомов порядка нескольких ангстрем. Ангстрем - это внесистемная единица длины,  . Число атомов или молекул в любом макроскопическом теле огромно. Например, найденное опытным путем число атомов в 12 г изотопа углерода 12С равно . Число атомов или молекул в любом макроскопическом теле огромно. Например, найденное опытным путем число атомов в 12 г изотопа углерода 12С равно  . Это число называется числом Авогадро. В молекулярной физике вводится единица количества вещества - моль (в системе СИ). Один моль - это количество вещества, в котором содержится столько же молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг. Отсюда следует: в одном моле любого вещества содержится одинаковое число атомов или молекул, это число называется числом Авогадро. Так как массы атомов очень малы, удобно использовать в расчетах не массы, измеренные в килограммах, а относительные массы. Относительной молекулярной (или относительной атомной) массой называют отношение массы молекулы (или атома) вещества к . Это число называется числом Авогадро. В молекулярной физике вводится единица количества вещества - моль (в системе СИ). Один моль - это количество вещества, в котором содержится столько же молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг. Отсюда следует: в одном моле любого вещества содержится одинаковое число атомов или молекул, это число называется числом Авогадро. Так как массы атомов очень малы, удобно использовать в расчетах не массы, измеренные в килограммах, а относительные массы. Относительной молекулярной (или относительной атомной) массой называют отношение массы молекулы (или атома) вещества к  массы атома углерода. Относительные атомные массы указаны в таблице Менделеева. Наряду с относительной молекулярной массой в физике и химии используется понятие молярная масса. Молярная масса вычисляется как масса одного моля вещества, выраженная в килограммах (в системе СИ). Например, молекулярная масса воды (Н2О) находится с помощью таблицы Менделеева и равна М = 1 ∙ 2 + 16 = 18. Молярная масса воды массы атома углерода. Относительные атомные массы указаны в таблице Менделеева. Наряду с относительной молекулярной массой в физике и химии используется понятие молярная масса. Молярная масса вычисляется как масса одного моля вещества, выраженная в килограммах (в системе СИ). Например, молекулярная масса воды (Н2О) находится с помощью таблицы Менделеева и равна М = 1 ∙ 2 + 16 = 18. Молярная масса воды 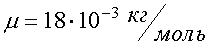 . 4.2. Уравнение состояния идеального газа Самой простой системой частиц является газ. В то же время его изучение имеет большое практическое значение, хотя бы потому, что газообмен определяет состояние всей биосферы Земли, в том числе человека. Вместо реального газа, между молекулами которого действуют сложные силы взаимодействия, мы будем рассматривать физическую модель - идеальный газ. Идеальным газом называется газ, в котором собственными размерами молекул и взаимодействием между молекулами можно пренебречь. Реальные разреженные газы ведут себя подобно идеальному, так как лишь небольшая доля молекул в них находится в состоянии соударения. Например, такие газы, как воздух, кислород, азот и т. д. при комнатной температуре и атмосферном давлении по своим свойствам близки к идеальному. Состояние заданной массы газа определяется значениями трех термодинамических параметров: давления p, объема V и температуры T. Связь между параметрами называется уравнением состояния. Уравнение состояния идеального газа может быть записано в разных формах. В наиболее общем виде уравнение состояния идеального газа установили французский ученый Б.П. Клапейрон и русский ученый Д.И. Менделеев. Уравнение Клапейрона-Менделеева имеет вид: . 4.2. Уравнение состояния идеального газа Самой простой системой частиц является газ. В то же время его изучение имеет большое практическое значение, хотя бы потому, что газообмен определяет состояние всей биосферы Земли, в том числе человека. Вместо реального газа, между молекулами которого действуют сложные силы взаимодействия, мы будем рассматривать физическую модель - идеальный газ. Идеальным газом называется газ, в котором собственными размерами молекул и взаимодействием между молекулами можно пренебречь. Реальные разреженные газы ведут себя подобно идеальному, так как лишь небольшая доля молекул в них находится в состоянии соударения. Например, такие газы, как воздух, кислород, азот и т. д. при комнатной температуре и атмосферном давлении по своим свойствам близки к идеальному. Состояние заданной массы газа определяется значениями трех термодинамических параметров: давления p, объема V и температуры T. Связь между параметрами называется уравнением состояния. Уравнение состояния идеального газа может быть записано в разных формах. В наиболее общем виде уравнение состояния идеального газа установили французский ученый Б.П. Клапейрон и русский ученый Д.И. Менделеев. Уравнение Клапейрона-Менделеева имеет вид:  где p - давление; V - объем; T - термодинамическая или абсолютная температура (вычисляется по шкале Кельвина, которая связана с температурой по шкале Цельсия соотношением где p - давление; V - объем; T - термодинамическая или абсолютная температура (вычисляется по шкале Кельвина, которая связана с температурой по шкале Цельсия соотношением  ); m - масса вещества, μ - молярная масса; ); m - масса вещества, μ - молярная масса;  - газовая постоянная. Уравнение Клапейрона - Менделеева формулируется так: произведение давления идеального газа на его объем, деленное на термодинамическую температуру, есть величина постоянная для данной массы газа. Отношение массы вещества к молярной массе называется количеством вещества - газовая постоянная. Уравнение Клапейрона - Менделеева формулируется так: произведение давления идеального газа на его объем, деленное на термодинамическую температуру, есть величина постоянная для данной массы газа. Отношение массы вещества к молярной массе называется количеством вещества 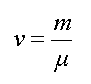 и измеряется в молях. Уравнению (4.1) можно придать другой вид. Обозначим через m 0 - массу одной молекулы, а N - полное число молекул. Тогда и измеряется в молях. Уравнению (4.1) можно придать другой вид. Обозначим через m 0 - массу одной молекулы, а N - полное число молекул. Тогда  где NA - число Авогадро. Количество вещества равно где NA - число Авогадро. Количество вещества равно  Подставим (4.2) в (4.1) и получим Подставим (4.2) в (4.1) и получим  Отношение газовой постоянной к числу Авогадро есть постоянная Больцмана Отношение газовой постоянной к числу Авогадро есть постоянная Больцмана  Тогда другая форма записи уравнения состояния идеального газа имеет вид Тогда другая форма записи уравнения состояния идеального газа имеет вид  Найдем связь давления и концентрации газа. Концентрацией называется число молекул, заключенных в единице объема: Найдем связь давления и концентрации газа. Концентрацией называется число молекул, заключенных в единице объема:  Из этого следует, что давление пропорционально концентрации, т. е. Из этого следует, что давление пропорционально концентрации, т. е.  Это еще одна форма записи уравнения состояния идеального газа. 4.3. Закон Дальтона для смеси газов На практике чаще встречаются не чистые газы, а их смеси. Компоненты смеси занимают один и тот же объем и имеют одинаковую температуру. Концентрация смеси равна сумме концентраций компонентов смеси, т. е. Это еще одна форма записи уравнения состояния идеального газа. 4.3. Закон Дальтона для смеси газов На практике чаще встречаются не чистые газы, а их смеси. Компоненты смеси занимают один и тот же объем и имеют одинаковую температуру. Концентрация смеси равна сумме концентраций компонентов смеси, т. е.  . Тогда по формуле (4.5) давление смеси равно . Тогда по формуле (4.5) давление смеси равно  . Введем обозначения: . Введем обозначения:  , где , где  - парциальные давления. Парциальным давлением называется давление, которое производит на стенки сосуда данная компонента смеси. Тогда давление смеси равно - парциальные давления. Парциальным давлением называется давление, которое производит на стенки сосуда данная компонента смеси. Тогда давление смеси равно  Формула (4.6) представляет собой закон Дальтона. Давление смеси газов равно сумме парциальных давлений. Формула (4.6) представляет собой закон Дальтона. Давление смеси газов равно сумме парциальных давлений. |
Задания и вопросы для самоконтроля
1. В чем заключается молекулярно-кинетические представления?
2. Что такое моль? Как находится молярная масса?
3. Запишите уравнение Менделеева - Клапейрона.
4. Сформулируйте закон Дальтона.
5. В чем физический смысл числа Авогадро?
 2015-10-22
2015-10-22 2434
2434