Вопросы для самопроверки
1. Какой газ называется идеальным?
2. Что такое нормальные физические условия? Какой объем занимает киломоль любого газа при нормальных физических условиях?
3. В чем сущность молекулярно-кинетический теории теплоемкости? Каковы основные недостатки этой теории?
4. В чем сущность квантовой теории теплоемкости? Какие преимущества имеет эта теория перед молекулярно-кинетической теории теплоемкости?
5. Какова связь между истинной и средней теплоемкостями? Как вычислить теплоту процесса с помощью каждой из этих теплоемкостей?
6. Какими свойствами обладают теплоемкости идеального газа?
7. Как связаны изобарная и изохорная теплоемкости идеального газа?
8. В какой форме может быть задана зависимость теплоемкости идеального газа от температуры?
9. Какими способами может быть задана смесь идеальных газов?
10. Что такое кажущаяся мольная масса смеси идеальных газов?
11. Сформулируйте закон Дальтона. В каком случае справедлив этот закон?
12. Что такое парциальное давление и парциальный (приведенный) объем?
13. Как рассчитывается теплоемкость смеси идеальных газов при различных способах задания этой смеси?
14. Получите выражение для определения удельной газовой постоянной смеси идеальных газов.
Термодинамическая система и окружающая среда. Изолированная и неизолированная термодинамические системы. Параметры состояния. Уравнение состояния. Термодинамическая поверхность. Термодинамический процесс. Равновесные и неравновесные процессы (взаимодействие). Теплота и работа как функции процесса. Внутренняя энергия и энтальпия как функции состояния термодинамической системы (рабочего тела).
Свойства внутренней энергии и энтальпии идеального газа. Энтропия как функция состояния. Таблицы термодинамических свойств идеальных газов. Изохорный, изобарный, изотермический и адиабатный процессы с идеальным газом. Политропные процессы и их анализ. Расчет количества теплоты и изменения температуры по таблицам значений энтальпии и внутренней энергии идеального газа.
Закон сохранения и превращения энергии. Первый закон термодинамики. Различные аналитические выражения первого закона термодинамики. Краткая история открытия первого закона термодинамики.
По теме выполняется одна лабораторная работа (№ 3), контрольная работа (задача № 4). После изучения теоретического материала следует ответить на вопросы для самопроверки по этой теме. Ответы также можно найти в учебниках [1,3].
Первый закон термодинамики установлен экспериментально на основании многовекового опыта человечества. Все процессы, происходящие в природе, протекают при строгом соблюдении этого закона.
Если к рабочему телу с массой m подводится теплота δQ, то при этом происходит, в общем случае, приращение внутренней энергии Δ U (рост температуры и давления) и совершается работа расширения δ L против сил окружающей среды. Применительно к этому процессу можно записать зависимость, выражающую универсальный закон сохранения и превращения энергии:
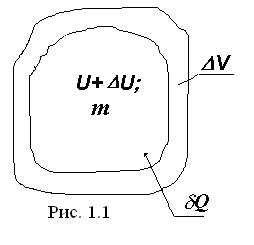
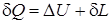 . (1.25)
. (1.25)
Поделив обе части последнего уравнения на массу рабочего тела m и далее произведя предельный переход, получим следующую зависимость
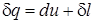 , (1.26)
, (1.26)
которая является математической записью первого закона термодинамики.
В литературе часто используются два варианта записи этого уравнения. В частности, используя формулу для элементарной работы расширения (1.1), выражение (1.26) можно представить в виде
δq=du+p∙dv. (1.27)
Преобразуя второе слагаемое в правой части последнего уравнения
pdv = d(pv) –vdp,
подставив его в (1.27) получим следующую форму записи первого закона термодинамики
δq=dh-v∙dp. (1.28)
Проанализируем некоторые характерные термодинамические процессы с помощью первого закона термодинамики.
а). Процесс протекает при постоянном удельном объеме (v= const., dv=0).
Из уравнения (1.27) при v =const, dv=0 следует
δq=du.
Последнее выражение рассматриваем совместно с формулой (1.9)
δq=du;
δq=сdT.
В силу равенства левых частей этих выражений, приравниваем их правые части и учитывая что, при v= const, c=сv, окончательно имеем
du = сvdT. (1.29)
б). Термодинамический процесс протекает при постоянном давлении (p= const, dp=0). Для этого случая из (1.28) следует
δq=dh.
Рассматривая это выражение совместно с формулой (1.9), получаем систему уравнений
δq=dh,
δq=сdT.
Приравнивая правые части этих выражений, учитывая так же, что теплоемкость данного процесса с=ср, приходим к следующей зависимости
dh= сpdT. (1.30)
В термодинамике идеального газа формулы (1.29 и 1.30), наряду с выражением для элементарной работы δ l=pdv (1.1), играют фундаментальную роль при анализе различных процессов.
 2014-02-24
2014-02-24 1442
1442
