Пример 1. Во сколько раз изменится скорость реакции 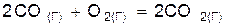 при увеличении давления в системе в 2 раза? Температура системы поддерживается постоянной.
при увеличении давления в системе в 2 раза? Температура системы поддерживается постоянной.
Решение. Предположим, что рассматриваемая реакция является элементарной, т. е. для нее справедлив закон действующих масс см. (23)
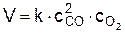 .
.
Принимая, что концентрация и парциальное давление связаны прямо пропорциональной зависимостью: 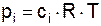 , получаем, что
, получаем, что 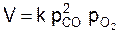 .
.
После увеличения давления в системе в 2 раза парциальное давление каждого из реагентов возрастает тоже в 8 раз, т. е. 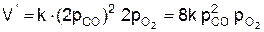 . Отсюда
. Отсюда 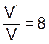 , следовательно, скорость реакции увеличится в 8 раз.
, следовательно, скорость реакции увеличится в 8 раз.
Пример 2. Вычислите, во сколько раз возрастет скорость реакции при увеличении температуры на 40 °С, если температурный коэффициент реакции равен 3?
Решение. Согласно математическому выражению правила Вант-Гоффа (28) в нашем примере Т2 – Т1 = 40 °С, подставив данные задачи в уравнение, получим VТ2/VТ1 = 3 40/10 = 34 = 81, т. е. скорость реакции возрастет в 81 раз.
Пример 3. При 353 К реакция заканчивается за 20 с. Сколько времени длится реакция при 293 К, если температурный коэффициент реакции равен 2,5?
Решение. Между скоростью протекания химических реакций и их продолжительностью существует обратно пропорциональная зависимость VТ2/VТ1 = t1/t2, где t1 и t2 – время протекания реакции при температурах Т1 и Т2, таким образом, в данном случае правило Вант-Гоффа можно записать следующим выражением:
t1/ t2 = gТ2–Т1/10; t1 = t2 ∙ gТ2–Т1/ 10 = 20 ∙ 2,5 353–293/ 10 = 20 ∙ 2,56 = 4879 с =
= 1 час 21 мин 19 с.
Пример 4. При синтезе аммиака равновесие установилось при следующих концентрациях реагирующих веществ: [N2] = 2,5 моль/л;
[Н2] = 1,8 моль/л; [NH3] = 3,6 моль/л. Рассчитайте константу равновесия этой реакции и исходные концентрации азота и водорода.
Решение. Исходя из уравнения реакции получения аммиака 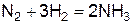 , определяем константу равновесия этой реакции:
, определяем константу равновесия этой реакции:
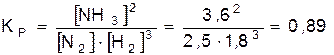 .
.
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 молей аммиака расходуется 1 моль азота, а на образование 3,6 молей потребовалось 3,6 /2 = 1,8 моля азота. Учитывая равновесную концентрацию азота, находим первоначальную концентрацию 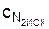 = 2,5 + 1,8 = 4,3 моль/л. На образование 2 молей аммиака необходимо истратить 3 моля водорода, а для получения 3,6 моля аммиака требуется 3,6 ∙ 3/ 2 = 5,4 моль/л;
= 2,5 + 1,8 = 4,3 моль/л. На образование 2 молей аммиака необходимо истратить 3 моля водорода, а для получения 3,6 моля аммиака требуется 3,6 ∙ 3/ 2 = 5,4 моль/л; 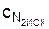 = 1,8 + 5,4 = 7,2 моль/л. Таким образом, реакция начиналась при концентрациях азота и водорода соответственно 4,3 и 7,2 моль/л.
= 1,8 + 5,4 = 7,2 моль/л. Таким образом, реакция начиналась при концентрациях азота и водорода соответственно 4,3 и 7,2 моль/л.
Пример 5. Рассчитайте изменение константы скорости реакции, имеющей энергию активации 191 кДж/моль, при увеличении температуры от330 до 400 К.
Решение. Зависимость константы скорости реакции от температуры определяется уравнением Аррениуса. Логарифм отношения констант скоростей реакции при температуре Т1 и Т2соответственно равен: 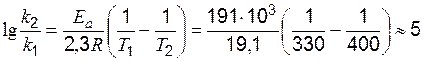 , следовательно
, следовательно 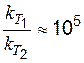 .
.
 2015-10-22
2015-10-22 5902
5902
