Химические свойства любого элемента определяются строением его атома. С исторической точки зрения теория строения атома последовательно разрабатывалась: Э. Резерфордом, Н. Бором, Л. де Бройлем,
Э. Шредингером и т. д.
Основные свойства и строение ядра (теория состава атомных ядер).
1. Ядра атомов всех элементов (за исключением водорода) состоят из протонов и нейтронов.
2. Число протонов в ядре определяет значение его положительного заряда (Z). Z – порядковый номер химического элемента в периодической системе Д.И. Менделеева.
3. Суммарное число протонов и нейтронов – значение его массы, так как масса атома в основном сосредоточена в ядре (99, 97% массы атома). Ядерные частицы – протоны и нейтроны – объединяются под общим названием нуклоны (от латинского слова nucleus, что означает ядро). Общее число нуклонов соответствует массовому числу, т. е.
округленной до целого числа его атомной массе А.
A = N + Z.
Ядра с одинаковыми Z, но различными А называются изотопами. Ядра, которые при одинаковом А имеют различные Z, называются изобарами. Всего известно около 300 устойчивых изотопов химических элементов и более 2000 естественных и искусственно полученных радиоактивных изотопов.
4. Число нейтронов в ядре N может быть найдено по разности между массовым числом А и порядковым номером Z:
N = A – Z.
5. Размер ядра характеризуется радиусом ядра, имеющим условный смысл ввиду размытости границы ядра.
● Квантовая механика. Корпускулярно-волновые свойства частиц
Современная теория строения атома основывается на расчетах квантовой механики. Квантовая механика – физическая теория, которая в настоящее время наилучшим образом описывает электронно-ядерные системы, т. е. атомы, молекулы, атомно-молекулярные ионы, химические частицы. В ее основе лежит представление о двойственной природе микрообъектов, т. е. они одновременно обладают корпускулярными и волновыми свойствами.
В основу квантовой механики легли положение М. Планка о том, что энергия излучается определенными порциями – квантами:
Е = h·n,
где h – постоянная Планка (h = 6,6256×10–34 В×с2), n – частота.
А. Эйнштейном показано, что масса тела m связана с энергией уравнением
Е = m×c2.
Из совместного решения уравнений:
l = h /mс,
где l – длина волны, с – скорость света.
Согласно теории Л. де Бройля (1924) корпускулярно-волновые свойства присущи всем микрочастицам, т. е. любой частице, имеющей массу m и движущееся со скоростью u, соответствует волна длиной l.
l = h/m υ (уравнение Л. де Бройля).
Таким образом, электронам, как и фотонам, присуще корпускулярно-волновая двойственность. Масса электрона и его заряд характеризуют его корпускулярные свойства. Волновые свойства проявляются в особенностях движения электрона, в дифракции и интерференции.
Чем меньше масса частицы, тем больше длина волны. Для элементарных частиц В. Гейзенберг сформулировал принцип неопределенности, согласно которому невозможно одновременно определить положение частицы в пространстве и ее импульс.
Следовательно, нельзя рассчитать траекторию движения электрона в поле ядра, можно лишь оценить вероятность его нахождения в атоме с помощью волновой функции ψ, которая заменяет классическое понятие траектории. Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ2 определяет пространственное распределение электрона в атоме. В наиболее простом варианте волновая функция зависит от трех пространственных координат и дает возможность определить вероятность нахождения электрона в атомном пространстве или его орбиталь. Таким образом, атомная орбиталь (АО) – область атомного пространства, в котором вероятность нахождения электрона наибольшая.
Волновые функции получаются при решении основополагающего соотношения волновой механики – уравнения Шредингера
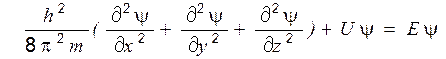 ,
,
где h – постоянная Планка; ψ – переменная величина; U – потенциальная энергия частицы; E – полная энергия частицы; х, у, z – координаты. (Точное решение получается для атома водорода или водородоподобных ионов, для многоэлектронных систем используются различные приближения). Поверхность, ограничивающая 90–95 % вероятности нахождения электрона или электронной плотности, называют граничной. Атомная орбиталь и плотность электронного облака имеют одинаковую граничную поверхность (форму) и одинаковую пространственную ориентацию. Атомные орбитали электрона, их энергия и направление в пространстве зависят от четырех параметров – квантовых чисел: главного, орбитального, магнитного и спинового. Первые три характеризуют движение электрона в пространстве, а четвертое – вокруг собственной оси.
Главное квантовое число n – определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3...) и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома, и какой энергетический уровень является внешним.
| Главное квантовое число n | |||||||
| Обозначение энергетического уровня | K | L | M | N | O | P | Q |
Например, элемент стронций Sr расположен в пятом периоде, значит, в его атоме электроны распределены по пяти энергетическим уровням
(n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5).
Орбитальное квантовое число l – определяет форму электронного облака (рис. 5) и энергию электрона на подуровне. Принимает значения от 0 до (n – 1). Кроме числовых значений l имеет буквенные обозначения. Электроны с одинаковым значением l образуют подуровень.
| орбитальное квантовое число l | |||||
| Обозначение энергетического подуровня | s | p | d | f | g |
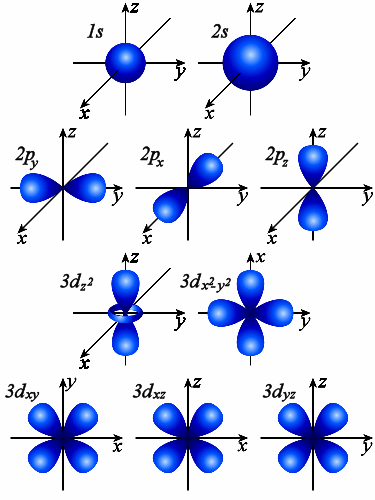
Рис. 5. Изображение форм и ориентаций s -, p -, d -орбиталей с помощью граничных поверхностей
Квантовое число m называют магнитным. Оно характеризует пространственное расположение атомной орбитали относительно внешней силы. Принимает целые значения от –l до +l через нуль, т. е. (2l + 1) значений (табл. 25).
Таблица 25
 2015-10-22
2015-10-22 687
687








