Сделайте задания согласно своему варианту (табл. 22).
Таблица 22
Исходные данные
| Вариант | Номера задач | Вариант | Номера задач | ||
| Задание 1 | Задание 2 | Задание 1 | Задание 2 | ||
| 1, 27 | 16, 26 | ||||
| 2, 28 | 17, 14 | ||||
| 3, 29 | 18, 13 | ||||
| 4, 30 | 19, 12 | ||||
| 5, 15 | 20, 11 | ||||
| 6, 16 | 21, 10 | ||||
| 7, 17 | 22, 9 | ||||
| 8, 18 | 23, 1 | ||||
| 9, 19 | 24, 2 | ||||
| 10, 20 | 25, 3 | ||||
| 11, 21 | 26, 4 | ||||
| 12, 22 | 27, 5 | ||||
| 13, 23 | 28, 8 | ||||
| 14,24 | 29, 7 | ||||
| 15, 25 | 30, 6 |
Задание 1. Решите задачи (табл. 23).
Таблица 23
Контрольные задачи
| Номер задачи | Условия |
| Две реакции при 283 К протекают с одинаковой скоростью. Температурный коэффициент скорости первой и второй реакции равны соответственно 2,5 и 3,0. Как будут относиться скорости реакций, если первую из них провести при 350 К, а вторую при 330 К? Ответ: 2,65: 1,00. | |
В начальный момент протекания реакции  концентрации были равны (моль/л): азота – 1,5; водорода – 2,5; аммиака – 0. Каковы концентрации азота и водорода при концентрации аммиака равной 0,5 моль/дм3? Ответ: 1,25 моль/м3; 1,75 моль/м3. концентрации были равны (моль/л): азота – 1,5; водорода – 2,5; аммиака – 0. Каковы концентрации азота и водорода при концентрации аммиака равной 0,5 моль/дм3? Ответ: 1,25 моль/м3; 1,75 моль/м3. | |
Начальные концентрации веществ в реакции  были равны (моль/м3): оксида углерода (II) – 0,05; паров воды – 0,06; оксида углерода (IV) – 0,4; водорода – 0,2. Вычислите концентрации всех реагирующих веществ, после того как прореагировало 60 % Н2О. Ответ: 0,24 мольд/м3; 0,14 моль/м3; 0,76 моль/м3; 0,56 моль/м3. были равны (моль/м3): оксида углерода (II) – 0,05; паров воды – 0,06; оксида углерода (IV) – 0,4; водорода – 0,2. Вычислите концентрации всех реагирующих веществ, после того как прореагировало 60 % Н2О. Ответ: 0,24 мольд/м3; 0,14 моль/м3; 0,76 моль/м3; 0,56 моль/м3. |
Продолжение табл. 23
| Номер задачи | Условия |
Реакция идет по уравнению  . Как изменится скорость реакции, если увеличить давление в 2 раза? Ответ: возрастет в 512 раз. . Как изменится скорость реакции, если увеличить давление в 2 раза? Ответ: возрастет в 512 раз. | |
Реакция протекает по уравнению  . Как изменится скорость реакции после разбавления реагирующей смеси в 4 раза? Ответ: уменьшится в 16 раз. . Как изменится скорость реакции после разбавления реагирующей смеси в 4 раза? Ответ: уменьшится в 16 раз. | |
| Вычислите, при какой температуре реакция закончится за 45 минут, если при 293 К на это требуется 3 часа. Температурный коэффициент равен 3,2. Ответ: 304,9 К. | |
| На сколько нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7. Ответ: 45,3 °C. | |
Определите равновесную концентрацию водорода в реакции  , если исходная концентрация HI составляет 0,55 моль/м3, а константа равновесия равна 0,12. Ответ: 0,11 моль/м3. , если исходная концентрация HI составляет 0,55 моль/м3, а константа равновесия равна 0,12. Ответ: 0,11 моль/м3. | |
При синтезе фосгена имеет место равновесие реакции  . Определите исходные концентрации хлора и оксида углерода, если равновесные концентрации в моль/м3 равны: [Cl2] = 2,5; [CO] = 1,8; [COCl2] = 3,2. Ответ: 5,0; 5,7 моль/м3. . Определите исходные концентрации хлора и оксида углерода, если равновесные концентрации в моль/м3 равны: [Cl2] = 2,5; [CO] = 1,8; [COCl2] = 3,2. Ответ: 5,0; 5,7 моль/м3. | |
| Реакция протекает по уравнению 2А = В. Исходная концентрация вещества А равна 0,2 моль/м3. Константа равновесия реакции 0,5. Вычислите равновесные концентрации веществ. Ответ: 0,015 и 0,17 моль/м3. | |
В каком направлении сместится равновесие реакции  , если концентрации всех реагирующих веществ уменьшить в 3 раза? , если концентрации всех реагирующих веществ уменьшить в 3 раза? | |
Равновесие в системе  при некоторой температуре установилось при концентрациях в моль/м3: [NO2] = 0,06; [NO] = 0,24; [O2] = 0,12. Определите константу равновесия и рассчитайте исходную концентрацию NO2. Ответ: 1,92; 0,3 моль/м3. при некоторой температуре установилось при концентрациях в моль/м3: [NO2] = 0,06; [NO] = 0,24; [O2] = 0,12. Определите константу равновесия и рассчитайте исходную концентрацию NO2. Ответ: 1,92; 0,3 моль/м3. | |
Определите равновесные количества веществ в реакции  , если константа равновесия при некоторой температуре равна 1 и для реакции было взято 1 моль углекислого газа и 3 моль водорода. Ответ: [H2] = 2,25; [CO2] = 0,25; [CO] = 0,75; [H2O] = 0,75 моль/м3. , если константа равновесия при некоторой температуре равна 1 и для реакции было взято 1 моль углекислого газа и 3 моль водорода. Ответ: [H2] = 2,25; [CO2] = 0,25; [CO] = 0,75; [H2O] = 0,75 моль/м3. | |
При некоторой температуре константа равновесия реакции  равна 1. Определите состав равновесной смеси, если для реакции были взяты 1 моль водорода и 2 моль брома. Ответ: равна 1. Определите состав равновесной смеси, если для реакции были взяты 1 моль водорода и 2 моль брома. Ответ:  = 0,55 моль. = 0,55 моль.  = 1,55 моль. = 1,55 моль.  = 0,90 моль. = 0,90 моль. |
Продолжение табл. 23
| Номер задачи | Условия |
| Для практической остановки реакции применяют быстрое охлаждение реакционной смеси. Определите, во сколько раз изменится скорость реакции при охлаждении реакционной смеси с 40 °С до –10 °С, если температурный коэффициент реакции равен 2,7. Ответ: в 143,5 раза. | |
Как измениться скорость реакции  , если увеличить объем газовой смеси в 3 раза и предположить, что реакция протекает в соответствии с законом действующих масс? Ответ: уменьшится в 9 раз. , если увеличить объем газовой смеси в 3 раза и предположить, что реакция протекает в соответствии с законом действующих масс? Ответ: уменьшится в 9 раз. | |
Константа равновесия для реакции  при 850 °С равна 1. Исходные концентрации воды – 0,03 моль/л, угарного газа – 0,01 моль/л. Определите концентрации всех четырех веществ при равновесии. Ответ: [СО] = 0,0025 моль/л, [СО2] = [Н2] = 0,075 моль/л, [Н2О] = 0,025 моль/л. при 850 °С равна 1. Исходные концентрации воды – 0,03 моль/л, угарного газа – 0,01 моль/л. Определите концентрации всех четырех веществ при равновесии. Ответ: [СО] = 0,0025 моль/л, [СО2] = [Н2] = 0,075 моль/л, [Н2О] = 0,025 моль/л. | |
Равновесие реакции, протекающей по уравнению  , установилось при следующих концентрациях: [Н2] = 0,004 моль/л, [I2] = 0,025 моль/л, [HI] = 0,08 моль/л. Определите константу равновесия этой реакции и исходные концентрации йода и водорода. Ответ: Кр = 64, 0,044 моль/л, 0,065 моль/л. , установилось при следующих концентрациях: [Н2] = 0,004 моль/л, [I2] = 0,025 моль/л, [HI] = 0,08 моль/л. Определите константу равновесия этой реакции и исходные концентрации йода и водорода. Ответ: Кр = 64, 0,044 моль/л, 0,065 моль/л. | |
Реакция протекает по уравнению:  . Равновесие установилось при следующих концентрациях участвующих в ней веществ: [NO] = 0,02 моль/л, [NО2] = 0,06 моль/л, [О2] = 0,3 моль/л. Определите константу равновесия и исходную концентрацию кислорода. Ответ: Кр = 30, 0,33 моль/л. . Равновесие установилось при следующих концентрациях участвующих в ней веществ: [NO] = 0,02 моль/л, [NО2] = 0,06 моль/л, [О2] = 0,3 моль/л. Определите константу равновесия и исходную концентрацию кислорода. Ответ: Кр = 30, 0,33 моль/л. | |
Обратимая реакция протекает по уравнению:  . Константа равновесия при определенной температуре равна 1. Определить концентрации всех реагирующих веществ при равновесии, зная, что исходные концентрации окиси углерода и водяного пара были 0,02 моль/л. Ответ: [СО] = [СО2] = [Н2О] = [Н2] = 0,01 моль/л. . Константа равновесия при определенной температуре равна 1. Определить концентрации всех реагирующих веществ при равновесии, зная, что исходные концентрации окиси углерода и водяного пара были 0,02 моль/л. Ответ: [СО] = [СО2] = [Н2О] = [Н2] = 0,01 моль/л. | |
| Скорость химической реакции при 20 °С равна 1 моль/(л·с). Вычислите скорость этой реакции при 60 °С, если температурный коэффициент равен 3. Ответ: 81 моль/(л·с). | |
Во сколько раз увеличиться скорость реакции  , если концентрацию водорода увеличить в 2 раза, а азота – в 4 раза? Ответ: в 32 раза. , если концентрацию водорода увеличить в 2 раза, а азота – в 4 раза? Ответ: в 32 раза. | |
| При охлаждении реакционной смеси с 50 до 20 °С скорость химической реакции уменьшилась в 27 раз. Вычислите температурный коэффициент этой реакции. Ответ: 3. |
Окончание табл. 23
| Номер задачи | Условия |
| На сколько градусов надо повысить температуру газообразной реакционной смеси, чтобы скорость реакции увеличилась в 125 раз, если температурный коэффициент равен 5? Ответ: на 30° | |
Как измениться скорость химической реакции  , если давление системы увеличить в 5 раз? , если давление системы увеличить в 5 раз? | |
При наступлении равновесия реакции  концентрации веществ имели следующие значения: азота 0,5 моль/л, водорода 1,5 моль/л, аммиака 1 моль/л. Рассчитайте исходные концентрации азота и водорода. Ответ: 1 моль/л и 3 моль/л. концентрации веществ имели следующие значения: азота 0,5 моль/л, водорода 1,5 моль/л, аммиака 1 моль/л. Рассчитайте исходные концентрации азота и водорода. Ответ: 1 моль/л и 3 моль/л. | |
| Реакция при температуре 40 °С протекает за 180 с. Температурный коэффициент реакции равен 3. За сколько секунд завершиться эта реакция при 60 °С? Ответ: за 20 с. | |
| Исходные концентрации азота и водорода в реакционной смеси для получения аммиака составили 4 и 10 моль/л соответственно. При наступлении равновесия прореагировало 50 % азота. Вычислите равновесные концентрации азота, водорода и аммиака. Ответ: [N2] = 2 моль/л, [NH3] = [H2] = 4 моль/л. | |
| Реакция при температуре 50 °С протекает за 200 с. Температурный коэффициент данной реакции равен 2. За сколько времени закончится эта реакция при 70 °С? Ответ: за 50 с. | |
| Скорость химической реакции при 50 °С равна 5 моль/(л·с). Вычислите скорость этой реакции при 100 °С, если температурный коэффициент равен 2. Ответ: 160 моль/(л·с). |
Задание 2.
1. По значениям констант скоростей реакции  и
и  при двух температурах определите энергию активации и предэкспоненциальный множитель.
при двух температурах определите энергию активации и предэкспоненциальный множитель.
2. Рассчитайте константу скорости при температуре Т3. Сделайте вывод о влиянии температуры на скорость вашей реакции.
3. Постройте график зависимости константы скорости от температуры в аналитической форме  (табл. 24).
(табл. 24).
Таблица 24
Контрольное задание [10]
| Вариант | Реакция | Т1, К |  | Т2, К |  | Т3, К |
 | 202×10–3 мин–1 | 4,1×10–3 мин–1 | ||||
 | 2,5×105 с–1 | 141,5×105 с–1 | ||||
 | 2,59×10–2 мин–1 | 3,43×10–2 мин–1 | ||||
 | 5,03×10–2 мин–1 | 2,1×10–2 мин–1 | ||||
 | 666,8 | 0,256 см3/(моль×с) | 698,6 | 1,242 см3/(моль×с) | ||
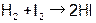 | 666,8 | 15,59 см3/(моль×с) | 698,6 | 67,0 см3/(моль×с) | ||
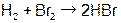 | 3,6×10–4 дм3/(моль× мин) | 8,6 ×10–2 дм3/(моль× мин) | ||||
 | 4,76×104 дм3/(моль× мин) | 1,07×103 дм3/(моль× мин) | ||||
 | 1,59×10–2 дм3/(моль× мин | дм3/(моль× мин) | ||||
 | 3,05×10–4 дм3/(моль×с) | 6,33×10–5 дм3/(моль× с) | ||||
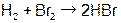 | 1,59×10–2 дм3/(моль× мин) | 2,6×10–3 дм3/(моль× мин) | ||||
 | 0,203×102 дм3/(моль× мин) | 0,475×10–3 дм3/(моль× мин) | ||||
 | 5,1 см3/(моль×с) | 46,2 см3/(моль×с | ||||
 | 0,0336 дм3/(моль× мин) | 2,125 дм3/(моль× мин) | ||||
 | 0,942×10–6 дм3/(моль× мин) | 0,31×10–2 дм3/(моль× мин) |
Тестовые задания
1. Скорость химических процессов при введении в систему катализатора увеличивается за счет:
а) увеличения кинетической энергии молекул
б) возрастания числа столкновений
в) уменьшения числа активных молекул
г) уменьшения энергии активации
2. Равновесие гетерогенной системы СО2(г) + С(графит) ↔ 2СО(г ) смещается в сторону исходных веществ путем:
а) увеличения объема
б) повышения давления
в) повышения концентрации углекислого газа
г) понижения концентрации угарного газа
3. Закон «действующих масс» (Гульберг, Вааге) устанавливает зависимость скорости реакции от:
а) температуры процесса
б) химической природы реагирующих веществ
в) концентрации реагирующих веществ
г) катализатора
4. Кинетическим уравнением для гомогенного процесса 2NО(г) + О2(г) = = 2NО2(г) является:
а) 
б) 
в) 
г) 
5. Укажите определение энергии активации химического процесса:
а) общий запас внутренней энергии системы
б) разница между потенциальной энергией молекул продуктов реакции и исходных веществ
в) внутренняя энергия химической системы, способная совершать механическую работу.
г) избыточная кинетическая энергия молекул, которая позволяет разрушить связи между атомами, что приводит к образованию новых химических связей.
6. Скорость реакции 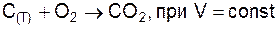 и увеличении количества реагентов в 4 раза возрастет в
и увеличении количества реагентов в 4 раза возрастет в
а) 4 раза
б) 8 раз
в) 16 раз
г) 32 раза
7. При охлаждении равновесие реакции 
а) сместится влево
б) сместится вправо
в) не сместится
8. Для смещения равновесия реакции  вправо необходимо:
вправо необходимо:
а) увеличить концентрацию О2
б) увеличить концентрацию CS2
в) повысить температуру
г) повысить давление
9. Химическое равновесие смещается за счет:
а) изменения температуры процесса
б) введения катализатора
в) увеличение концентрации реагирующих веществ
г) изменения давления
10. Изменение концентрации одного из реагирующих веществ в единицу времени в единице реакционного пространства, называется _____.
СТРОЕНИЕ АТОМА
 2015-10-22
2015-10-22 2099
2099
