Задание. Ответьте на вопрос и решите задачу своего варианта (табл. 35).
Таблица 35
Варианты контрольного задания
| Вариант | Условия |
| 1. Чем характеризуется внутреннее строение кристаллов? | |
| 2. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 10, 37? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? | |
| 1. В чем заключается явление анизотропии, характерное для кристаллов? | |
| 2. Чем отличается структура кристалла СН4 от структуры кристаллов Н2 и Салмаз? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? | |
| 1. Какой тип кристаллической решетки имеет самое твердое природное вещество? | |
| 2. Охарактеризуйте полупроводниковые свойства кристалла Салмаз. Как изменяться эти свойства, если кристалл содержит примеси Sb и Al? | |
| 1. Укажите химические связи в каждом из следующих кристаллов: аргон, кремний. | |
| 2. Чем отличается структура кристалла MgCl2 от структуры кристаллов Mg и Cl2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? | |
| 1. Назовите типы кристаллических решеток. Чем характеризуется каждый тип? | |
| 2. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 14, 19? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? | |
| 1. Какие физические свойства характерны для веществ с ионной кристаллической решеткой? | |
| 2. Чем отличается структура кристалла CuJ2 от структуры кристаллов Cu и J2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? | |
| 1. Какие физические свойства характерны для веществ с молекулярной кристаллической решеткой? | |
| 2. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 32, 36? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? | |
| 1. Охарактеризуйте основные параметры кристаллической решетки. | |
| 2. Охарактеризуйте полупроводниковые свойства кристалла Sb(т). Как изменятся эти свойства, если кристалл содержит примеси Sn и Te? | |
| 1. Какие виды агрегатного состояния веществ существуют? Охарактеризуйте их свойства. | |
| 2. Чем отличается структура кристалла BaCl2 от структуры кристаллов Ba и Cl2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? |
Продолжение табл. 35
| Вариант | Условия |
| 1. Как делятся вещества по величине электропроводности? Дайте им характеристику. | |
| 2. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 11, 33? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? | |
| 1. Охарактеризуйте свойства газообразных веществ. | |
| 2. Охарактеризуйте полупроводниковые свойства кристалла Ge(т). Как изменятся эти свойства, если кристалл содержит примеси Ga и As? | |
| 1. Что такое собственная проводимость полупроводников? | |
| 2. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 18, 30? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? | |
| 1. Охарактеризуйте свойства твердого тела. | |
| 2. Охарактеризуйте полупроводниковые свойства кристалла B(т). Как изменятся эти свойства, если кристалл содержит примеси Zn и Ge? | |
| 1. Охарактеризуйте свойства жидкости. | |
| 2. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 1, 3? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? | |
| 1. Дайте характеристику аморфным и кристаллическим веществам. В чем их сходство и отличие? | |
| 2. Охарактеризуйте полупроводниковые свойства кристалла As(т). Как изменятся эти свойства, если кристалл содержит примеси Pb и Se? | |
| 1. Чем объясняется различие в электропроводимости твердых тел? | |
| 2. Чем отличается структура кристалла NaCl от структуры кристаллов Na и Cl2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? | |
| 1. Охарактеризуйте зонную теорию строения твердого вещества. | |
| 2. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 7, 53? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? | |
| 1. Какие вещества являются собственными полупроводниками. Приведите примеры. | |
| 2. Охарактеризуйте полупроводниковые свойства кристалла S(т). Как изменятся эти свойства, если кристалл содержит примеси Bi и Cl? | |
| 1. Охарактеризуйте понятие: «дефект» кристалла. | |
| 2. Чем отличается структура кристалла H2S от структуры кристаллов H2 и S? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? | |
| 1. Как появляются точечные дефекты в ионных кристаллах? | |
| 2. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 40, 2? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? |
Окончание табл. 35
| Вариант | Условия |
| 1. Охарактеризуйте понятие: «электронно-дырочная проводимость (n-p) типа». | |
| 2. Охарактеризуйте полупроводниковые свойства кристалла Se(т). Как изменятся эти свойства, если кристалл содержит примеси Sb и J? | |
| 1. Дайте объяснение усилению дырочной проводимости в кристаллах. | |
| 2. Чем отличается структура кристалла SiF от структуры кристаллов Si и F2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? | |
| 1. Как появляется дополнительная ионная проводимость в кристаллах? | |
| 2. Охарактеризуйте полупроводниковые свойства кристалла Snсерое. Как изменятся эти свойства, если кристалл содержит примеси Tl и P? | |
| 1. Укажите химические связи в каждом из следующих кристаллов: вода, хлорид кальция. | |
| 2. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 21, 28? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? | |
| 1. Дайте объяснение усилению примесной проводимости n-типа в кристаллах. | |
| 2. Чем отличается структура кристалла LiN3 от структуры кристаллов Li и N2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? | |
| 1. Какие физические свойства характерны для веществ с атомной кристаллической решеткой? | |
| 2. Чем отличается структура кристалла Zn3As2 от структуры кристаллов As и Zn? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? | |
| 1. Какие физические свойства характерны для веществ с металлической кристаллической решеткой? | |
| 2. Охарактеризуйте полупроводниковые свойства кристалла Te(т). Как изменятся эти свойства, если кристалл содержит примеси Br и N? | |
| 1. Укажите химические связи в каждом из следующих кристаллов: йод, графит, алюминий и серная кислота. | |
| 2. Охарактеризуйте полупроводниковые свойства кристалла Bi(т). Как изменятся эти свойства, если кристалл содержит примеси С и Po? | |
| 1. Дайте объяснение усилению электронной проводимости в кристаллах. | |
| 2. Чем отличается структура кристалла SiF4 от структуры кристаллов Si и F2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? | |
| 1. Дайте объяснение усилению примесной проводимости р-типа в кристаллах. | |
| 2. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 6, 82? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? |
Тестовые задания
1. Молекулярная кристаллическая решетка характерна для кристалла:
а) NiCl2(к)
б) H2O(к)
в) Si(к)
г) H2SO4(к)
2. Атомная кристаллическая решетка характерна для кристалла:
а) NiCl2(к)
б) H2O(к)
в) Si(к)
г) Na(к)
3. Основными признаками, отличающими агрегатные состояния веществ, являются:
а) размеры частиц и их строение
б) заряд частиц и их внутренняя энергия
в) вид атомов, образующих молекулы и ионы
г) соотношение кинетической и потенциальной энергий частиц и расстояние между ними
4. Свойства веществ с ионной кристаллической решеткой:
а) легкоплавкое, летучее, имеет запах
б) твердое, тугоплавкое, растворимое в воде
в) твердое, тугоплавкое, не растворимое в воде, проводит электрический ток
г) твердое, легкоплавкое, растворимое в воде
5. Свойства веществ с атомной кристаллической решеткой:
а) легкоплавкое, летучее, имеет запах
б) твердое, тугоплавкое, растворимое в воде
в) твердое, тугоплавкое, не растворимое в воде, проводит электрический ток
г) твердое, легкоплавкое, растворимое в воде
6. Свойства веществ с металлической кристаллической решеткой:
а) легкоплавкое, летучее, имеет запах
б) твердое, тугоплавкое, растворимое в воде
в) твердое, тугоплавкое, не растворимое в воде, проводит электрический ток
г) твердое, легкоплавкое, растворимое в воде
7. Вещества с металлической кристаллической решеткой – это
а) 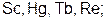
б) 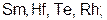
в) 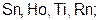
г) 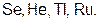
8. Установите соотвествие между кристаллической решеткой и вещетвом:
| Кристаллическа решетка | Вещество |
| а) металлическая б) молекулярная в) ионная г) атомная (ковалентная) | 1) фторид калия 2) сера 3) алмаз 4) аргон 5) вольфрам |
9. Веществами молекулярного строения являются:
а) 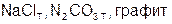
б) 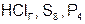
в) 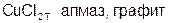
г) 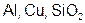
ПРИЛОЖЕНИЕ 1
важнейшие кислоты и соли
| Формула | Название | |
| кислоты | соли | |
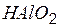 | метаалюминиевая | метаалюминат |
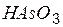 | метамышьяковая | метаарсенат |
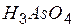 | ортомышьяковая | ортоарсенат |
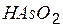 | метамышьяковистая | метаарсенит |
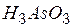 | ортомышьяковистая | ортоарсенит |
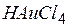 | тетрахлорауратоводород | тетрахлораурат |
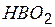 | метаборная | метаборат |
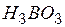 | ортоборная | ортоборат |
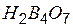 | четырехборная | тетраборат |
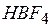 | тетрафторборная | тетрафторборат |
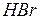 | бромоводород | бромид |
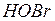 | бромноватистая | гипобромит |
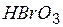 | бромноватая | бромат |
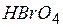 | пербромная | пербромат |
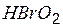 | бромистая | бромит |
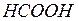 | муравьиная | формиат |
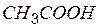 | уксусная | ацетат |
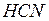 | циановодород (синильная) | цианид |
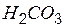 | угольная | карбонат |
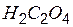 | щавелевая | оксалат |
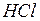 | хлороводород (соляная) | хлорид |
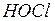 | хлорноватистая | гипохлорит |
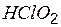 | хлористая | хлорит |
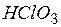 | хлорноватая | хлорат |
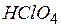 | хлорная | перхлорат |
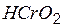 | метахромистая | метахромит |
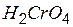 | хромовая | хромат |
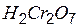 | двухромовая | дихромат |
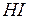 | йодоводород | йодид |
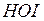 | йодноватистая | гипойодит |
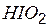 | йодистая | йодит |
Окончание прил. 1
| Формула | Название | |
| кислоты | соли | |
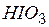 | йодноватая | йодат |
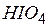 | йодная | перйодат |
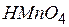 | марганцовая | перманганат |
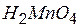 | марганцовистая | манганат |
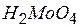 | молибденовая | молибдат |
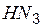 | азидоводород (азотистоводородная) | азид |
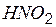 | азотистая | нитрит |
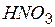 | азотная | нитрат |
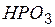 | метафосфорная | метафосфат |
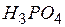 | ортофосфорная | ортофосфат |
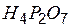 | двуфосфорная (пирофосфорная) | дифосфат (пирофосфат) |
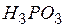 | фосфористая (фосфоновая) | фосфит |
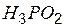 | фосфорноватистая (фосфиновая) | гипофосфит |
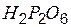 | гипофосфорная (дифосфорная) | гипофосфат |
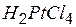 | тетрахлорплатиновая | тетрахлорплатинат |
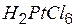 | гексахлорплатиновая | гексахлорплатинат |
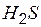 | сероводород | сульфид |
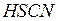 | родановодород | роданид |
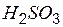 | сернистая | сульфит |
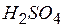 | серная | сульфат |
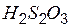 | тиосерная (серноватистая) | тиосульфат |
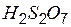 | двусерная (пиросерная) | дисульфат (пиросульфат) |
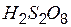 | пероксодвусерная (надсерная) | пероксодисульфат (персульфат) |
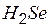 | селеноводород | селенид |
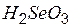 | селенистая | селенит |
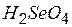 | селеновая | селенат |
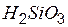 | кремниевая | силикат |
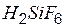 | гексафторкремниевая | гексафторсиликат |
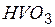 | ванадиевая | ванадат |
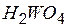 | вольфрамовая | вольфрамат |
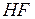 | фтороводород (плавиковая) | фторид |
ПРИЛОЖЕНИЕ 2
Термодинамические свойства веществ
| Вещество | 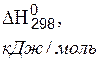 | 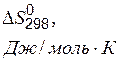 | 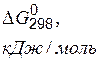 |
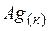 | 42,7 | ||
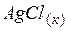 | –125,5 | 96,1 | –109,7 |
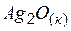 | –32,2 | 121,7 | –10,8 |
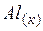 | 28,33 | ||
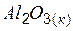 | –1675,69 | 50,92 | –1582,27 |
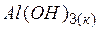 | –1276,1 | 83,8 | –1157,0 |
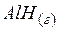 | 248,95 | 187,75 | 193,0 |
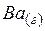 | 64,9 | ||
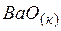 | –553,6 | 70,3 | –528,0 |
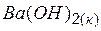 | –946,1 | 103,8 | –886,2 |
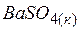 | –1465,0 | 132,2 | –1458,8 |
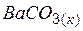 | –1211,0 | 112,1 | –1244,41 |
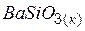 | –1590,1 | 109,6 | –1525,9 |
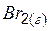 | 245,3 | ||
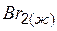 | 152,3 | ||
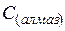 | 2,4 | ||
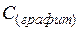 | 5,7 | ||
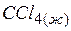 | –135,4 | 214,4 | –64,6 |
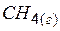 | –74,9 | 186,2 | –50,8 |
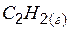 | 226,8 | 200,8 | 209,2 |
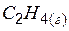 | 52,3 | 219,4 | 68,1 |
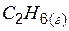 | –89,7 | 229,5 | –32,9 |
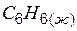 | 82,9 | 269,2 | 129,7 |
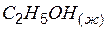 | –277,6 | 160,7 | –174,8 |
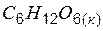 | –1273,0 | – | –919,5 |
Продолжение прил. 2
| Вещество | 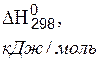 | 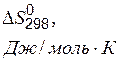 | 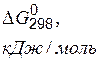 |
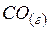 | –110,5 | 197,5 | –137,1 |
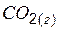 | –393,5 | 213,7 | –394,4 |
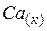 | 41,63 | ||
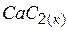 | –62,7 | 70,22 | –67,72 |
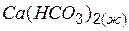 | –1925,22 | 129,91 | –1725,82 |
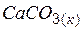 | –1207,0 | 88,7 | –1127,7 |
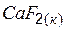 | –1214,6 | 68,9 | –1161,9 |
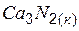 | –431,8 | –368,6 | |
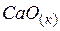 | –635,5 | 39,7 | –604,2 |
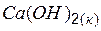 | –986,6 | 76,1 | –896,8 |
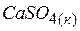 | –1422,33 | 108,26 | –1310,51 |
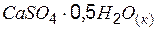 | –1431,32 | 106,59 | –1319,04 |
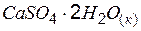 | –1760,62 | 183,92 | –1563,74 |
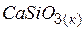 | –1585,55 | 81,93 | –1609,92 |
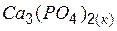 | –4122,31 | 240,77 | –3886,15 |
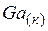 | 41,1 | ||
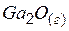 | –95,25 | 284,44 | –180,02 |
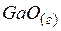 | 146,8 | 213,71 | 82,51 |
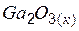 | –1091,0 | 84,94 | –1116,31 |
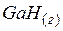 | 214,3 | 199,67 | 154,8 |
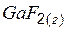 | –534,45 | 279,39 | –617,71 |
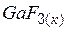 | –1175,0 | 96,0 | –941,4 |
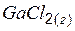 | –241,24 | 300,91 | –330,91 |
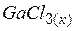 | –524,7 | 133,4 | –492,8 |
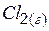 | 222,9 | ||
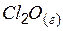 | 76,6 | 266,2 | 94,2 |
Продолжение прил. 2
| Вещество | 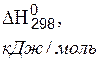 | 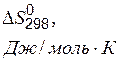 | 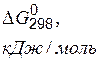 |
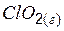 | 105,0 | 257,0 | 122,3 |
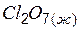 | 251,0 | – | – |
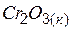 | –1440,6 | 81,2 | –1050,0 |
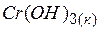 | –987,4 | 80,5 | –900,9 |
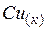 | 33,3 | ||
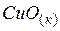 | –162,0 | 42,6 | –129,9 |
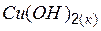 | –444,0 | 70,2 | –359,8 |
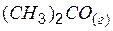 | –216,19 | 294,65 | –151,73 |
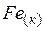 | 27,15 | ||
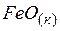 | –264,8 | 60,8 | –244,3 |
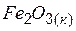 | –822,2 | 87,4 | –740,3 |
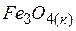 | –1117,1 | 146,2 | –1014,2 |
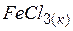 | –401,8 | 119,4 | –302,0 |
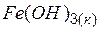 | –841,0 | 96,6 | –6946 |
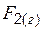 | 202,9 | ||
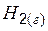 | 130,52 | ||
| HBr 2 (г) | –36,3 | 198,6 | –53,3 |
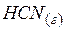 | 135,0 | 113,1 | 125,5 |
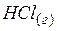 | –91,8 | 186,8 | –94,79 |
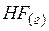 | –270,7 | 178,7 | –272,8 |
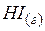 | 26,6 | 206,5 | 1,8 |
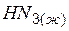 | 294,0 | 328,0 | 238,8 |
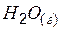 | –241,8 | 188,7 | –228,6 |
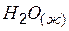 | –285,8 | 70,1 | –237,3 |
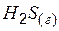 | –21,0 | 205,7 | –33,8 |
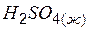 | –813,99 | 156,90 | –690,14 |
Продолжение прил. 2
| Вещество | 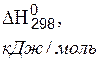 | 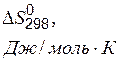 | 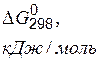 |
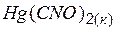 | –118,33 | 177,11 | –27,75 |
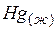 | 76,1 | ||
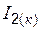 | 116,7 | ||
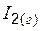 | 260,6 | ||
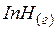 | 214,7 | 207,55 | 152,85 |
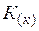 | 64,3 | ||
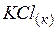 | –435,9 | 82,6 | –408,0 |
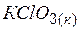 | –391,2 | 143,0 | –289,9 |
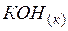 | –424,7 | 59,4 | –380,2 |
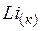 | 28,0 | ||
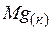 | 32,5 | ||
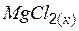 | –641,1 | 89,9 | –591,6 |
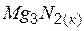 | –461,1 | 87,9 | –400,9 |
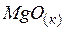 | –601,8 | 26,9 | –569,6 |
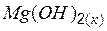 | –924,66 | 63,18 | –833,75 |
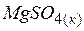 | –1287,42 | 91,55 | –1173,25 |
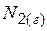 | 191,5 | ||
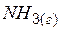 | –46,2 | 192,6 | –16,7 |
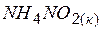 | –256 | – | – |
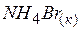 | –270,1 | 112,8 | –174,7 |
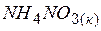 | –365,4 | –183,8 | |
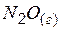 | 82,0 | 219,9 | 104,1 |
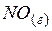 | 90,3 | 210,6 | 86,6 |
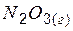 | 83,3 | 307,0 | 140,5 |
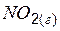 | 33,5 | 240,2 | 51,5 |
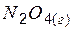 | 9,6 | 303,8 | 98,4 |
Продолжение прил. 2
| Вещество | 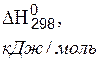 | 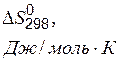 | 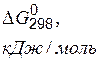 |
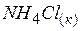 | –315,39 | 94,5 | –204,0 |
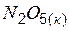 | –42,7 | 114,1 | |
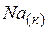 | 51,4 | ||
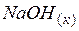 | –426,3 | 64,2 | –380,7 |
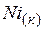 | 29,8 | ||
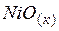 | –239,7 | 38,0 | –211,6 |
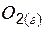 | 205,0 | ||
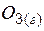 | 238,8 | ||
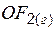 | 25,1 | 247,0 | 42,5 |
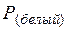 | 44,3 | ||
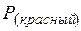 | 22,8 | ||
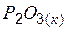 | –820 | 173,5 | – |
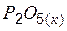 | –1492 | 114,5 | –1348,8 |
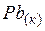 | 64,9 | ||
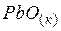 | –219,3 | 66,1 | –189,1 |
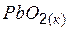 | –276,6 | 74,9 | –218,3 |
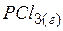 | –287,02 | 311,71 | –267,98 |
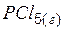 | –374,89 | 364,47 | –305,10 |
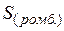 | 31,8 | ||
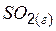 | –296,9 | 248,1 | –300,2 |
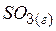 | –395,8 | 256,7 | –371,2 |
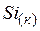 | 18,7 | ||
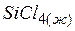 | –687,8 | 239,7 | – |
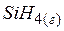 | 34,7 | 204,6 | 57,2 |
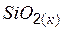 | –910,9 | 41,8 | –856,7 |
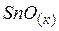 | –286,0 | 56,5 | –256,9 |
Окончание прил. 2
| Вещество | 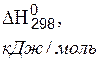 | 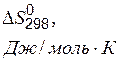 | 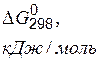 |
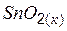 | –580,8 | 52,3 | –519,3 |
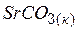 | –1227,0 | 97,2 | –1255,97 |
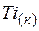 | 30,6 | ||
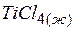 | –804,2 | 252,4 | –737,4 |
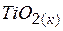 | –943,9 | 50,3 | –888,6 |
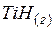 | 204,62 | 215,1 | 140,52 |
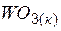 | –842,7 | 75,9 | –763,9 |
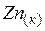 | 41,6 | ||
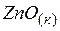 | –350,6 | 43,6 | –320,7 |
Приложение 3
Растворимость кислот, солей и оснований в воде
| Ионы | 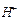 | 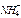 | 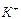 | 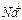 | 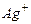 | 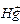 | 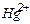 | 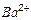 | 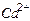 | 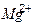 | 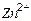 | 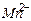 | 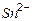 | 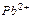 | 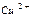 | 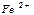 | 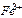 | 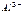 | 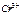 | 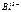 | 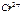 | 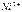 |
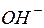 | – | – | – | м | м | н | н | н | м | н | н | н | н | н | н | н | н | |||||
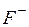 | н | м | м | н | н | м | м | н | н | м | н | |||||||||||
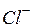 | н | н | – | м | – | – | ||||||||||||||||
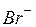 | н | н | м | – | ||||||||||||||||||
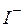 | н | н | н | м | н | – | – | – | ||||||||||||||
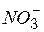 | – | |||||||||||||||||||||
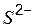 | н | н | н | м | н | н | н | н | н | н | – | – | – | н | н | н | ||||||
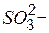 | н | н | н | н | н | н | н | н | – | н | н | н | – | – | – | н | – | н | ||||
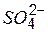 | м | м | н | м | н | |||||||||||||||||
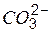 | м | м | н | н | н | н | н | н | н | – | н | н | н | н | – | – | н | – | н | |||
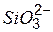 | н | – | н | – | – | н | н | н | н | н | н | н | н | н | н | н | н | – | н | н | ||
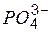 | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | ||||
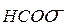 | м | |||||||||||||||||||||
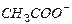 | м | м | ||||||||||||||||||||
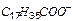 | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н |

Обозначения: м – малорастворимые; н – нерастворимые; – – не существуют; – растворимые
Приложение 4
Периодическая система элементов Д.И. Менделеева
| периоды | ГРУППЫ ЭЛЕМЕНТОВ | |||||||||
| I | II | III | IV | V | VI | VII | VIII | |||
| H 1 Водород 1,008 | Не 2 Гелий 4,00 | |||||||||
| Li 3 Литий 6,94 | Be 4 Бериллий 9,01 | В 5 Бор 10,81 | С 6 Углерод 12,01 | N 7 Азот 14,1 | О 8 Кислород 16,00 | F 9 Фтор 19,00 | Ne 10 Неон 20,18 | |||
| Na 11 Натрий 22,99 | Mg 12 Магний 24,31 | Al 13 Алюминий 26,98 | Si 14 Кремний 28,09 | Р 15 Фосфор 30,97 | S 16 Сера 32,06 | Cl 17 Хлор 35,45 | Ar 18 Аргон 39,95 | |||
| K 19 Калий 39,10 | Са 20 Кальций 40,08 | 21 Sc Скандий 44,96 | 22 Ti Титан 47,90 | 23 V Ванадий 50,94 | 24 Cr Хром 52.00 | 25 Mn Марганец 54,94 | 26 Fe Железо 55,85 | 27 Со Кобальт 58,93 | 28 Ni Никель 58,70 | |
| 29 Cu Медь 63,54 | 30 Zn Цинк 65,37 | Ga 31 Галлий 69,72 | Ge 32 Германий 72.61 | As 33 Мышьяк 74,92 | Se 34 Селен 78,96 | Br 35 Бром 79,90 | Kr 36 Криптон 83,80 | |||
| Rb 37 Рубидий 85,47 | Sr 38 Стронций 87,62 | 39 Y Иттрий 88,90 | 40 Zr Цирконий 91,22 | 41 Nb Ниобий 92,91 | 42 Mo Молибден 95,94 | 43 Тс Технеций | 44 Ru Рутений 101,07 | 45 Rh Родий 1.2,90 | 46 Pd Палладий 106,42 | |
| 47 Ag Cеребро 107.9 | 48 Cd Кадмий 112,41 | In 49 Индий 114,82 | Sn 50 Олово 118,71 | Sb 51 Сурьма 121,76 | Te 52 Теллур 127,60 | J 53 Йод 126,90 | Xe 54 Ксенон 131,30 | |||
| CS 55 Цезий 132,9 | Ва 56 Барий 137,33 | 57 * La Лантан 138,90 | 72 Hf Гафний 178,49 | 73 Та Тантал 180,94 | 74 W Вольфрам 183,84 | 75 Re Рений 186,20 | 76 Os Осьмий 190,23 | 77 Ir Иридий 192,22 | 78 Pt Платина 195,08 | |
| 79 Au Золото 197,0 | 80 Hg Ртуть 200,59 | Tl 1 Таллий 204,38 | Pb 82 Свинец 207,2 | Bi 83 Висмут 208,98 | Ро 84 Полоний | At 85 Астат | Rn 86 Радон 222,02 | |||
| Fr 87 Франций | Ra 88 Радий 226,03 | 89 ** Ac Актиний 227,03 | 104 Rf Резерфордий 261,11 | 105 Db Дубний 262,11 | 106 Sg Сиборгий 263,12 | 107 Bh Борий 262.12 | 108 Hs Хассий | 109 Mt Мейтнерий | 110 Ds | |
| 111 Rg | 112 Uub | Uut 113 | Uuq 114 | Uup 115 | Uuh 116 | Uus 117 310? | Uuo 118 314? |
| *Ланта ноиды | Ce58 Церий 140,12 | Pr 59 Празео- дим 40,9 | Nd 60 Неодим 144,24 | Pm 61 Прометий
 Сейчас читают про:
|
 2015-10-22
2015-10-22 3258
3258







