1. В сосуде объемом 2 м3 находится смесь 4 кг гелия и 2 кг водорода температуре 27°С. Определить давление и молярную массу смеси газов.
Дано: V=2 м3, m1 = 4 кг, М1=4.10-3 кг/моль, m2=2 кг, М2=2.10-3 кг/моль, Т=300 К.
Найти: Р, М.
Решение. Воспользуемся, уравнением Клапейрона—Менделеева, применив его к гелию и водороду:
p1V =m1RT/M1 (1), p2V =m2RT/M2 (2)
где p1 - парциальное давление гелия; m1 — масса гелия; M1 — его
молярная масса; V — объем сосуда; Т — температура газа;
R = 8,31 Дж/(моль.К)—молярная газовая постоянная; р2 —парциальное водорода; m2 —масса водорода; М2 — его молярная масса. Под парциальным давлением p1 и p2 понимается то давление, которое производил бы газ, если бы он только один находился в сосуде. По закону Дальтона давление смеси равно сумме парциальных давлений газов, входящих в состав смеси: р=р1+р2. Из уравнений (1) и (2) выразим р1 и р2 и подставим в уравнение (3):

Найдем молярную массу смеси газов по формуле M=(m1+m2)/(v1+v2) (5) где v1 и v2 — число молей гелия и водорода соответственно. Число молей газов найдем по формулам:. v1=m1/M1 (6), v2=m2/M2 (7). Подставляя (6) и (7) в (5), найдем:
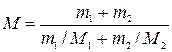
Подставляя числовые значения в формулы (4) и (8), получаем:
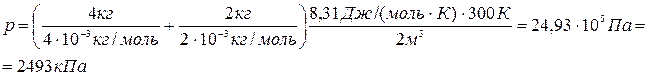
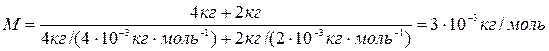
Ответ: р=2493 кПа, M=3.10-3 кг/моль.
2. Чему равны средние кинетические энергии поступательного и вращательного движения молекул, содержащихся в 2 кг водорода при температуре 400 К?
Дано: m = 2 кг, T=400 К, M=2.10-3 кг/моль.
Найти: <εпост>, <εвр>.
Решение. Считаем водород идеальным газом. Молекула водорода — двухатомная, связь между атомами считаем жесткой, тогда число степеней свободы молекулы водорода равно 5. В среднем на одну степень свободы приходится энергия <εi>=kT/2, где k — постоянная Больцмана; Т — термодинамическая температура. Поступательному движению приписывается три (i=3), а вращательному две (i=2) степени свободы. Тогда энергия одной молекулы
<εпост> = 3/2кТ, <εвр> = 2/2 kТ.
Число молекул, содержащихся в массе газа, N=vNA =(m/M)NA где v —число молей; NА — постоянная Авогадро. Тогда средняя кинетическая энергия поступательного движения молекул водорода будет
<εпост> =(m/M)NA .3/2 kT = 3/2 (m/M)RT, (1)
где R=kNА —молярная газовая постоянная.
Средняя кинетическая энергия вращательного движения молекул водорода
<εвр> = (m/M) RT. (2)
Подставляя числовые значения в формулы (1) и (2), имеем
<εпост>= 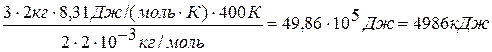
<εвр>= 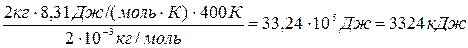
Ответ: <εпост> = 4986 кДж, <εвр>=2324 кДж.
3. Определить среднюю длину свободного пробега молекул и число соударений за 1 с, происходящих между всеми молекулами кислорода, находящегося в сосуде емкостью 2 л при температуре 27° С и давлении 100 кПа.
Дано: V = 2л=2.10-3 м3, M=32.10-3 кг/моль, Т=300 К, p = 100 кПа=105 Па, в=2,9.10-10 м.
Найти: <λ>,Z.
Решение. Средняя длина свободного пробега молекул кислорода вычисляется по формуле < λ > = l / 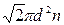 , (1) где d — эффективный диаметр молекулы кислорода; n — число молекул в единице объема, которое можно определить из уравнения p=nkT, откуда n=p/(kT), (2) где k — постоянная Больцмана. Подставляя (2) в (1), имеем
, (1) где d — эффективный диаметр молекулы кислорода; n — число молекул в единице объема, которое можно определить из уравнения p=nkT, откуда n=p/(kT), (2) где k — постоянная Больцмана. Подставляя (2) в (1), имеем
< λ > = kT/(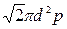 ) (3)
) (3)
Число соударений Z, происходящих между всеми молекулами за 1 с равно
Z = ½<Z> N (4)
где N - число молекул кислорода в сосуде объемом 2.10-3 м3;
<Z> - среднее число соударений одной молекулы за 1 с. Число молекул в сосуде N=nV. (5). Среднее число соударений молекулы за 1 с равно <Z> = <v>/< λ >, (6) где <v> — средняя арифметическая скорость молекулы <v>= 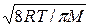 . (7)
. (7)
Подставляя в (4) выражения (5), (6) и (7), находим
Z= 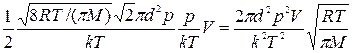
Подставляя числовые значения, получим
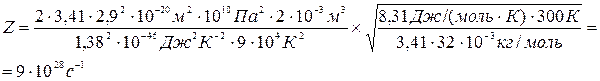
<λ>= 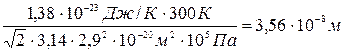
Ответ: Z=9.1028 c-1, < λ > = 3,56.10-8м.
4. Определить коэффициенты диффузии и внутреннего трения азота, находящегося при температуре Т=300 К и давлении 105 Па.
Дано: po =1,25 кг/м3, M=28.10-3 кг/моль, Т=300 К, р=105 Па, d=3,1.10-10 м.
Найти: D, η.
Решение. Коэффициент диффузии определяется по формуле
D=1/3 <v> <λ>,
где < v > - средняя арифметическая скорость молекул, равная < v >= 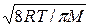 . (2) <λ> — средняя длина свободного пробега молекул. Для нахождения <λ> воспользуемся формулой, взятой из решения примера 3: < λ >=kT/(
. (2) <λ> — средняя длина свободного пробега молекул. Для нахождения <λ> воспользуемся формулой, взятой из решения примера 3: < λ >=kT/(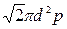 ). (3) Подставляя (2) и (3) в выражение (1), имеем (4)
). (3) Подставляя (2) и (3) в выражение (1), имеем (4)
D= 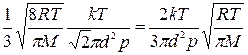
Коэффициент внутреннего трения
η = 1/3<v>< λ >р, (5)
где ρ — плотность газа при температуре 300 К и давлении 105 Па, Для нахождения ρ воспользуемся уравнением состояния идеального газа. Запишем его для двух состояний азота — при нормальных условиях (Tо = 273 К, р=1,01.105 Па) и условиях задачи:
p0V0 = (m/M)RT0, pV = (mlM) RT. (6)
Учитывая, что ρo=m/V0, ρ = m/V, имеем ρ=ρорТо/(роТ), (7)
Коэффициент внутреннего трения газа может быть выражен через коэффициент диффузии [см. (1) и (5)]:
η = Dp = Dρ0pT0/(p0T). (8)
Подставляя числовые значения в (4) и (8), получим
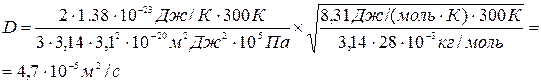
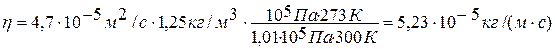
Ответ: D=4,7 . 10-5 м2/с, η= 5,23 . 10-3 кг/(м . с)..
5. Кислород массой 160 г нагревают при постоянном давлении от 320 до 340 К. Определить количество теплоты, поглощенное газом, изменение внутренней энергии и работу расширения газа.
Дано: m=160 г=16.10-2 кг,Т1=320 К, Т2=340 К.
Найти: Q, ∆U, А.
Решение. Количество теплоты, необходимое для нагревания газа при постоянном давлении,
Q = mcp (Т2 – T1) = (m/M) Ср (Т2 – T1). (1)
Здесь ср и Ср=Мср — удельная и молярная теплоемкости газа при постоянном давлении; М=32.10-3 кг/моль — молярная масса кислорода. Для всех двухатомных газов
Ср = 7/2R; Ср = 3,5.8,31 Дж/(моль.К) = 29 Дж/(моль.К).
Изменение внутренней энергии газа находим по формуле
∆U =(m/М)Сv/(T2-T1), где Cv —молярная теплоемкость газа при постоянном объеме. Для всех двухатомных газов
Cv = 5/2 R; Сv = 2,5.8,31 Дж/(моль.К) = 20,8 Дж/(моль.К).
Работа расширения газа при изобарном процессе A = р∆V, где ∆V=V2-V1 — изменение объема газа, которое можно найти из уравнения Клапейрона-Менделеева. При изобарном процессе
pV1 = (m/M)RT1, (3) pV2 = (m/M)RT2. (4)
Почленным вычитанием выражения (4) из (3) находим
p(V2-V1) = (m/M)R(T2-T1),
следовательно,
A = (m/M)R(T2-T1) (5)
Подставляя числовые значения в формулы (1), (2) и (5), получаем:
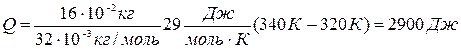
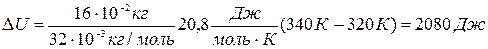
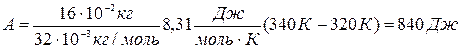
Ответ: Q=2900 Дж, ∆U = 2080 Дж, A=840 Дж.
6. Объем аргона, находящегося при давлении 80 кПа, увеличился от 1 до 2 л. На сколько изменится внутренняя энергия газа, если расширение производилось: а) изобарно; б) адиабатно.
Дано: V1= 10-3 м3, V2=2.10-3 м3, p=0,8.105 Па, М=40.10-3 кг/моль, i = 3.
Найти ∆U.
Решение. Применим первый закон термодинамики. Согласно этому закону количество теплоты Q, переданное системе, расходуется на увеличение внутренней энергий ∆U и на внешнюю механическую работу A: Q=∆U+A. (1) Величину ∆U можно определить, зная массу газа m, удельную теплоемкость при постоянном объеме Cv и изменение температуры ∆T: ∆U =mcv∆T. (2) Однако удобнее изменение внутренней энергии ∆U определять через молярную теплоемкость Cv, которая может быть выражена через число степеней свободы: Cv= Cv/M=1/2 R/M. (3) Подставляя величину Cv из формулы (3) в (2), получаем
∆U = (m/M). (i/2). R∆T. (4)
Изменение внутренней энергии зависит от характера процесса, при котором идет расширение газа. При изобарном расширении газа согласно первому закону термодинамики часть количества теплоты идет на изменение внутренней энергии ∆U, которая выражается формулой (4). Найти ∆U для аргона по формуле (4) нельзя, так как масса газа и температура в условии задачи не даны. Поэтому необходимо провести преобразование формулы (4).
Запишем уравнение Клапейрона-Менделеева для начального и конечного состояний газа:
pV1=(m/M)RT1 и pV2 = (m/M) RT2,
или
p(V2-V1)=(m/M)R(T2-T1)
Подставив (5) в формулу (4), получим
∆U= (i/2)p(V2-V1).
Это уравнение является расчетным для определения ∆U при изобарном расширении.
При адиабатном расширении газа теплообмена с внешней средой не происходит, поэтому Q=0. Уравнение (1) запишется в виде ∆U+A=0. (7) Это соотношение устанавливает, что работа расширения газа может быть произведена только за счет уменьшения внутренней энергии газа (знак минус перед ∆U):
А=— ∆U. (8)
Формула работы для адиабатного процесса имеет вид
A= 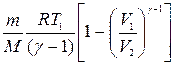
где γ — показатель степени адиабаты, равный отношению теплоемкостей: γ = Cp/Сv=(i+2)/i. Для аргона — одноатомного газа (i=3) имеем γ = 1,67.
Находим изменение внутренней энергии при адиабатном процессе для аргона, учитывая формулы (8) и (9):
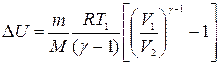
Для определения работы расширения аргона формулу (10) следует преобразовать, учитывая при этом параметры, данные в условии задачи. Применив уравнение Клапейрона—Менделеева для данного случая p1V1 = (m/M)RT1, получим выражение для подсчета изменения внутренней энергии:
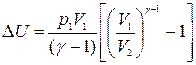
Подставляя числовые значения в (6) и (11), получим
при изобарном расширении
∆U=3\2.0,8.105Па.10-3 м3= 121 Дж
б) при адиабатном расширении
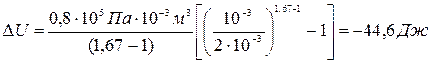
Ответ: a) ∆U=121 Дж; б) ∆U=-44,6 Дж.
7. Температура нагревателя тепловой машины 500 К. Температура холодильника 400 К. Определить КПД тепловой машины, работающей по циклу Карно, и полную мощность машины, если нагреватель ежесекундно передает ей 1675 Дж теплоты.
Дано: Т=500 К, Т0=400 К, Q=1675 Дж.
Найти: η, N.
Решение: КПД машины определяется по формуле:
η = (T-T0)/T (1) или η=A/Q (2)
Из выражений (2) и (1) находим
A= η Q=(T-T0)/T.
Произведем вычисления:
Η = (500К-400К)/500К = 0,2;
A=0,2.1675 Дж = 335 Дж.
Эта работа совершается за 1 с, следовательно, полная мощь машины 335 Вт.
Ответ: η=0.2, N=335Вт.
8. Горячая вода некоторой массы отдает теплоту холодной воде такой же массы и температуры их становятся одинаковыми. Показать, что энтропия при этом увеличивается.
Решение: пусть температура горячей воды T1, холодной Т2, а температура смеси θ. Определим температуру смеси, исходя из уравнения теплового баланса
mc (T2- θ)= mc (θ- T2), или Т1- θ= θ-Т2,
откуда θ=(Т1+Т2)/2. (1)
Изменение энтропии, происходящее при охлаждении горячей воды,
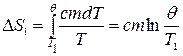
Изменение энтропии, происходящее при нагревании холодной воды,
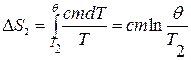
Изменение энтропии системы равно
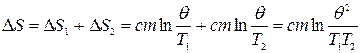
или с учетом соотношения (1) имеем

так как (Т1+Т2)2>4T1T2, то ∆S>0.
9. Вычислить эффективный диаметр молекул азота, если его критическая температура 126 К, критическое давление 3,4 МПа.
Дано: Ткр = 126 К, ркр = 3,4 .106 Па.
Найти d.
Решение. Азот, согласно условию задачи, должен подчиняться уравнению Ван-дер-Ваальса:
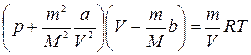
Постоянную b в уравнении Ван-дер-Ваальса с достаточной степенью точности считают равной учетверенному собственному объему 1 моля газа. В 1 моле газа находится 6,02*1023 молекул (NA = 6,02*1023 моль-1), следовательно, объем одной молекулы равен
V= 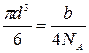
Откуда
d= 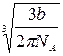
Постоянная b = Tкp R /(8pкр), тогда
d= 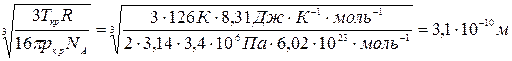
Ответ: d=3,1.10-10 м.
 2015-10-22
2015-10-22 2615
2615
