Приступая к изучению раздела «Основы молекулярной физики и термодинамики», студенты должны уяснить, что существуют два качественно различных и взаимодополняющих метода исследования физических свойств макроскопических систем — статистический (молекулярно-кинетический) и термодинамический. Молекулярно-кинетический метод исследования лежит в основе молекулярной физики, термодинамический — в основе термодинамики. Молекулярно-кинетическая теория является важнейшей теорией, которая позволяет с единой точки зрения рассмотреть самые различные явления во всех состояниях вещества, вскрыть физическую сущность этих явлений и теоретическим путем вывести многочисленные закономерности, открытые экспериментально и имеющие большое практическое значение.
При изучении молекулярно-кинетической теории следует уяснить, что свойства огромной совокупности молекул отличны от свойств каждой отдельной молекулы и свойства макроскопической системы и конечном счете определяются свойствами частиц системы, особенностями их движения и средними значениями кинематических характеристик частиц, т. е. их скоростей, энергий и т. д.
В отличие от молекулярно-кинетической теории термодинамика не изучает конкретно молекулярные взаимодействия, происходящие с отдельными атомами или молекулами, а рассматривает взаимопревращения и связь различных видов энергии, теплоты и работы. Термодинамика базируется на двух опытных законах (началах), которые позволяют описывать физические явления, связанные с превращением энергии макроскопическим путем.
При изучении основ термодинамики студент должен четко усвоить такие понятия, как термодинамическая система, термодинамические параметры (параметры состояния), равновесное состояние, уравнение состояния, термодинамический процесс, внутренняя энергия, энтропия и т. д.
Контрольная работа № 2 построена таким образом, что она дает возможность проверить знания студентов по основным вопросам данного раздела.
В задачах на тему «Основы молекулярно-кинетической теории» внимание уделено таким вопросам программы, как уравнение Клапейрона-Менделеева, уравнение молекулярно-кинетической теории, средние кинетические энергии поступательного и вращательного движения молекул, средняя длина свободного пробега и среднее число соударений, явления переноса.
Задачи по теме «Основы термодинамики» охватывают такие важные соотношения и понятия, как первое начало термодинамики, внутренняя энергия, работа при различных изопроцессах и адиабатном процессе. Включены также задачи, которые позволяют изучить и понять такие вопросы, как второе начало термодинамики и энтропия идеального газа, являющаяся в отличие от количества теплоты функцией состояния. В работе представлены задачи на определение КПД цикла Карно, изменение энтропии, на уравнение Ван-дер-Ваальса, которое объясняет отличие свойств реальных газов от идеальных.
Основные законы и формулы:
Количество вещества v=N/NA или v=m/M
Уравнение Клапейрона-Менделеева (уравнение состояния идеального газа)
pV=(m/M)RT
Закон Дальтона p=p1+p2+….+pn
Концентрация молекул n=N/V=NAρ/M
Уравнение молекулярно-кинетической теории газов p=1/3 nm0<vкв>2=2/3n<εпост>=nkt
Средняя кинетическая энергия молекулы <ε>=ikT/2
Внутренняя энергия идеального газа U=imRT/(2M)
Скорости молекул:
средняя квадратичная <v>= 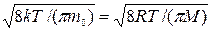
vB= 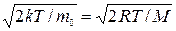
средняя арифметическая <vкв>= 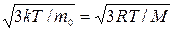
Средняя длина свободного пробега молекулы <λ>= 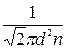
Среднее число соударений молекулы за 1 с <Z>= 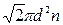 <v>
<v>
Распределение молекул в потенциальном поле сил (распределение Больцмана)
n=n0 e-EП /(kT)
Барометрическая формула p=p0 e –mg(h-h0)/(kT)
| Уравнение диффузии (закон Фика) | 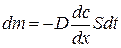 |
| Сила внутреннего трения в жидкости и газе | 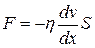 |
| Уравнение теплопроводности | 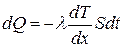 |
| Коэффициент диффузии | D=1/3<v><λ> |
| Коэффициент внутреннего трения (динамическая вязкость) | η=1/3ρ<λ><v>=Dρ |
| Коэффициент теплопроводности | λ=1/3cvρ<λ><v>=ηcv |
| Уравнение Майера | Cp-Cv=R |
| Теплоемкость молярная: | |
| Изохорная | Cv=iR/2; Cv=cvM |
| Изобарная | Cp=(i+2)R/2; Cp=cpM |
| Первое начало термодинамики | Q=∆U+A |
| Работа расширения газа при: | |
| Изобарном процессе | A=p(V2-V1)=(m/M)R(T2-T1) |
| Изотермическом процессе | A= 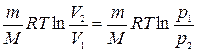 |
| Адиабатном процессе | A= 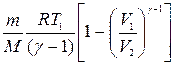 |
| Уравнение Пуассона, связывающие параметры идеального газа при адиабатном процессе | pVγ=const; TVγ-1=const; 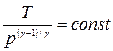 |
| Коэффициент полезного действия цикла Карно | 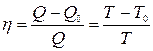 |
| Изменение энтропии | 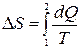 |
| Уравнение Ван-дер-Ваальса | 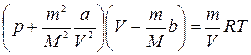 |
Критические параметры pкр = 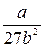 ; Ткр =
; Ткр = 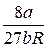 ; Vкр=3b
; Vкр=3b
Собственный объем молекулы V= 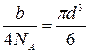
 2015-10-22
2015-10-22 773
773








