ИДЕАЛЬНЫХ ГАЗОВ
3.1. Основное уравнение кинетической теории газов для давления:

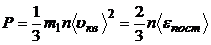 ,
,
где m1 - масса одной молекулы; n – концентрация молекул; 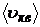 - средняя квадратичная скорость молекул.
- средняя квадратичная скорость молекул.
3.2. Средняя кинетическая энергия поступательного движения молекулы:

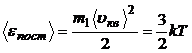 .
.
(Эта формула раскрывает молекулярно – кинетическое толкование температуры: она – мера средней кинетической энергии поступательного движения молекул идеального газа).
3.3 Закон о равномерном распределении энергии по степеням свободы молекул: на каждую степень свободы приходится в среднем одинаковая энергия, равная
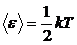 .
.
3.4. Средняя энергия молекулы:
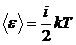 ,
,
где i - число степеней свободы молекулы данного газа: для одноатомных молекул i = 3 (поступательных), для двухатомных i = 5 (3 поступательных + 2 вращательных), для всех многоатомных i = 6 (3 поступательных + 3 вращательных).
3.5. Внутренняя энергия массы m газа:
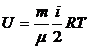 .
.
3.6. Скорости газовых молекул:
· средняя квадратичная
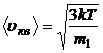 или
или 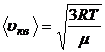 ,
,
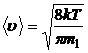 или
или 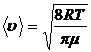 ,
,
· вероятная
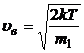 или
или 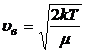 .
.
Пример 2. Найти среднюю квадратичную скорость, среднюю кинетическую энергию поступательного движения и среднюю полную кинетическую энергию молекул гелия и азота при температуре t = 27 оС. Определить полную энергию всех молекул каждого из газов. Массы газов одинаковы (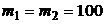 г).
г).
Дано: t = 27оС; T =300 K; =100г = 100ּ10-3кг; μ1 = 4г/моль = 4·10-3кг/моль; i1 = 3; μ 2 = 28г/моль = 28· 10-3кг/моль; і2 = 5.
Найти: 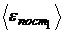 ;
; 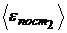 ;
; 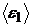 ;
; 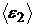 ;
;  ;
; 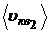 ; U 1; U 2 .
; U 1; U 2 .
Решение. 1. Средняя кинетическая энергия поступательного движения одной молекулы при данной температуре T одинакова для любых молекул, т.е.
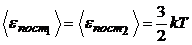 .
.
2. Полная кинетическая энергия молекулы газа определяется по формуле:
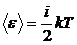 ,
,
тогда для молекул двух разных газов:
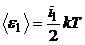 ,
, 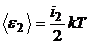 .
.
3. Внутренняя энергия, заключенная в 100 г каждого из газов, определяется по формулам:
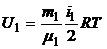 ,
, 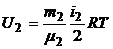 .
.
4. Средняя квадратичная скорость молекул этих газов зависит от их молярной массы газа или от их масс, т.е.
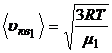 ,
, 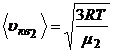 .
.
Проверим размерность:
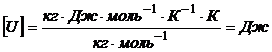 ;
;
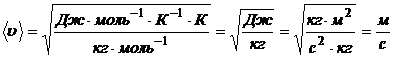 .
.
Произведем вычисления:
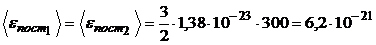 Дж;
Дж;
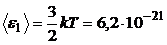 Дж;
Дж;
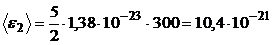 Дж;
Дж;
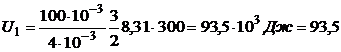
 кДж;
кДж;
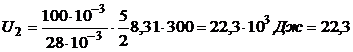 кДж;
кДж;
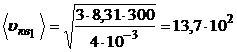 м/с;
м/с;
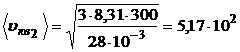 м/с.
м/с.
Ответ: 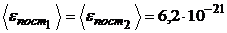 Дж;
Дж; 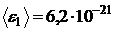 Дж;
Дж; 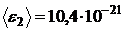 Дж;
Дж; 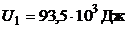 ;
; 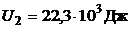 ;
; 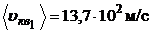 ;
; 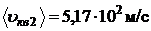 .
.
4. ТЕПЛОЕМКОСТИ ИДЕАЛЬНОГО ГАЗА
4.1. Теплоемкость системы (тела):
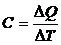 ,
,
где ∆Q – количество теплоты, сообщенное системе (телу); ∆Т – изменение температуры системы (тела), вызванное сообщением этого количества теплоты.
4.2. Молярная и удельная теплоемкости:
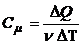 ;
; 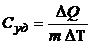 .
.
4.3. Молярные теплоемкости идеального газа при постоянном объеме С vμ и постоянном давлении С рμ:
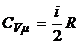 ,
, 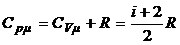 .
.
4.4. Соотношение между молярной и удельной теплоемкостями:
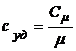 .
.
4.5. Удельные теплоемкости идеального газа при постоянном объеме и постоянном давлении:
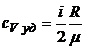 ,
, 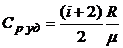 .
.
4.6. Отношение теплоемкостей (показатель адиабаты):
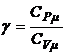 или
или 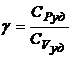 или
или 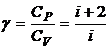 .
.
4.7. Количество теплоты, израсходованное на нагревание данного вещества: 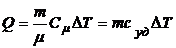 .
.
Пример 3. Вычислить удельные теплоемкости газа, зная, что его молярная масса µ = 4· 10-3кг/моль и отношение теплоемкостей γ = 1,67.
Дано: μ = 4·10-3 кг/моль; γ = 1,67.
Найти: с Vуд, 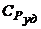 .
.
Решение. Исходя из классической теории теплоемкостей идеального газа, имеем:

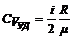 ,
, 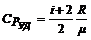 .
.
Определим i из выражения:

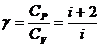 ,
,
отсюда
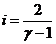 ,
, 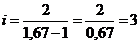 .
.
Следовательно, газ одноатомный.
Проверим размерность:
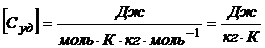 .
.
Производим вычисления:
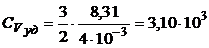 Дж/(кг×К);
Дж/(кг×К); 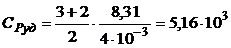 Дж/(кг×К).
Дж/(кг×К).
 2017-11-30
2017-11-30 868
868








