1. Количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, термохимическое уравнение которой:
2 Mg + O2 = 2MgO + 1204 кДж, равно
а) 602 кДж б) 301 кДж в) 2408 кДж г) 1803 кДж
2. В реакцию, термохимическое уравнение которой S + O2 = SO2 + 297 кДж, вступила сера массой 1 г. Количество теплоты, выделившееся при этом, равно:
а) 9,28 кДж б) 2,97 кДж в) 29,7 1 кДж г) 74,25 кДж
3. Какое количество теплоты выделится при сгорании графита массой 2,4 г, если термохимическое уравнение реакции C + O2 = CO2 + 402 кДж?
а) 984 кДж б) 40,2 кДж в) 98,4 кДж г) 80,4 кДж
4. Термохимическое уравнение горения фосфора: 4P + 5O2 = 2P2O5 + 3010 кДж. Какое количество теплоты выделится при сгорании 62 г фосфора?
а) 6020 кДж б) 752,5 кДж в) 301кДж г) 1505 кДж
5. Какое количество теплоты выделится при сгорании метана объемом 5,6 л (н.у.), если термохимическое уравнение реакции СН4 + 2О2 = СО2 + 2Н2О + 892 кДж?
а) 22,3 кДж б) 2,23 кДж в) 223 кДж г) 446 кДж
6. Сколько теплоты выделится при растворении 200 г оксида меди (II) (СuO) в соляной кислоте, если термохимическое уравнение реакции: CuO + 2HCl = CuCl2 + H2O + 63,6 кДж
а) 159 кДж б) 318 кДж в) 15,9кДж г) 636 кДж
7. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Масса сгоревшего ацетилена составила:
а) 13 г б) 26 г в) 52г г) 5,2г
8. В результате горения 48 г метана выделилось 2406 кДж теплоты. Количество теплоты, указанное в термохимическом уравнении этой реакции составит:
а) 401 кДж б) 802 кДж в) 1203кДж г) 4812 кДж
9. На разложение бертолетовой соли по реакции, термохимическое уравнение которой
2KClO3 = 2KCl + 3O2 – 91 кДж,
было затрачено 182 кДж теплоты. Объем кислорода (при н.у.) выделившийся при этом, составил:
а) 134,4л б) 44,8л в) 89,6л г) 179,2л
10. В результате реакции, термохимическое уравнение которой H2+ Cl2 = 2HCl + 184,36 кДж, выделилось 921,8 кДж теплоты. Объем хлора, затраченный на образование хлороводорода (при н.у.) при этом составил:
а) 134,4л б) 112л в) 44,8л г) 96л
11. Согласно термохимическому уравнению реакции 2СО(г) + О2(г) = 2СО2(г) + 566 кДж при сжигании оксида углерода (II) выделилось 424,5 кДж теплоты. Объем (н.у.) сгоревшего газа составил
а) 66,2 л б) 33,6 л в) 44,8 л г) 12 л
12. Согласно термохимическому уравнению реакции 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O + 385 кДж, при получении 15,68 л NO (н.у.), количество выделившейся теплоты составило:
а) 358 кДж б) 716 кДж в) 134,75 кДж г) 22,4 кДж
13. По термохимическому уравнению реакции 2Сu + О2 = 2СuО + 311 кДж вычислите. Количество теплоты, которая выделится при окислении 384 г меди, составит:
а) 622 кДж б) 716 кДж в) 466,5 кДж г) 933 кДж
14. В результате реакции, термохимическое уравнение которой
2Cl2O7 = 2Cl2 + 7O2 + 574 кДж, выделилось 5,74 кДж теплоты. Объем образовавшегося при этом кислорода (н.у.) составил:
а) 100 л б) 0,224 л в) 1,568 л г) 4,48 л
15. В реакцию, термохимическое уравнение которой MgO(тв) + CO(г) = MgCO3(тв) + 102 кДж, вступило 8 г оксида магния. Количество теплоты, выделившейся при этом, равно:
а) 102 кДж б) 204 кДж в) 20,4 кДж г) 1,02 кДж
Ответы (ключ)
| № | |||||||||||||||
| ответ | г | а | в | г | в | а | а | б | а | б | б | в | г | в | в |
Тема 2.3. Химическая кинетика и катализ
Задания
1. Систематическая проработка конспектов занятий, учебной и специальной химической литературы.
2. Подготовка к практическому занятию с использованием методических рекомендаций преподавателя.
3. Подготовка к лабораторной работе с использованием методических рекомендаций преподавателя.
4. Решение задач по теме "Скорость химической реакции".
5. Составление конспекта по теме: «Кинетика процессов выпечки и сушки пищевых продуктов в общественном питании».
Порядок выполнения задания: решение задач по теме "Скорость химической реакции".
Самостоятельная работа обучающихся:
1. Изучить алгоритм решения задач.
2. Решить предложенные задачи.
Алгоритм решения задач по теме "Скорость химической реакции"
Задача № 1. В некоторый момент времени концентрация хлора в сосуде, в котором протекает реакция H2+ Cl2 = 2HCl, была равна 0,06 моль/л. Через 5 сек концентрация хлора составила 0,02 моль/л. Чему равна средняя скорость данной реакции в указанный промежуток времени?
| Дано: | Решение: |
| C1 (Cl2) = 0,06 моль/л C2 (Cl2) = 0,02 моль/л ?t = 5 сек |  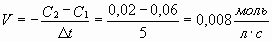 Ответ: V = 0,008 моль/л.с. Ответ: V = 0,008 моль/л.с. |
| V =? |
Задача № 2. Как изменится скорость протекающей в водном растворе реакции FeCl3 + 3KCNS = Fe(CNS)3+ 3KCl при разбавлении реагирующей смеси водой в два раза?
| Дано: | Решение: |
| C(ионов) < 2 раза |   пусть до разбавления пусть до разбавления  , тогда , тогда  . В результате разбавления концентрация ионов уменьшается: . В результате разбавления концентрация ионов уменьшается:    Ответ: Ответ:  |
 |
Задача № 3. Как изменится скорость реакции при повышении температуры от 55? до 100?С, если температурный коэффициент скорости этой реакции равен 2,5?
| Дано: | Решение: |
   | 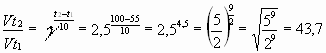 Ответ: скорость реакции увеличивается в 43,7 раза. Ответ: скорость реакции увеличивается в 43,7 раза. |
 |
Задача № 4. При повышении температуры на 30?С скорость некоторой реакции увеличивается в 64 раза. Чему равен температурный коэффициент скорости этой реакции?
| Дано: | Решение: |
  | 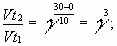  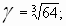  Ответ: температурный коэффициент скорости реакции равен 4. Ответ: температурный коэффициент скорости реакции равен 4. |
 |
 2017-11-30
2017-11-30 2040
2040
