Итак, работа и теплота суть воздействия, т.е. способы, с помощью которых может изменяться состояние термодинамической системы при её взаимодействии с внешней средой. (Работа и теплота – две единственных, с точки зрения ТД, формы передачи энергии, а количество работы и количество тепла являются мерами энергии, передаваемой в указанных формах. Работа – в обобщенном ТД понимании есть любая макрофизическая форма передачи энергии, тогда как теплота есть совокупность микрофизических процессов передачи энергии.) Термодинамика стала "точной" наукой после того, как были предложены и апробированы адекватные, логически оправданные "рецепты" вычисления этих воздействий.
Работа обозначается в термодинамике буквой L и вычисляется по аналогии с механикой, т.е. как скалярное произведение силы и перемещения. Если речь идёт только об изменении объёма, то под перемещением следует понимать перемещение каждого из бесконечно малых элементов поверхности оболочки, ограничивающей систему, относительно её центра инерции.
Сила, действующая со стороны термодинамической системы на элементарную площадку оболочки, пропорциональна величине этой площадки, т.е.
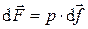 . (1.20)
. (1.20)
Согласно известному закону Паскаля, давление в однородных системах, каковыми являются газы и жидкости, не зависит от ориентации площадки и постоянно по объёму системы в отсутствие внешних полей или при не очень больших размерах.
Работа системы при конечном изменении её объёма от V 1 до V 2 вычисляется интегрированием:
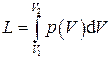 , (1.23)
, (1.23)
причём следует иметь в виду, что в общем случае давление в системе является функцией её объёма.
Отнесённая к единице массы системы работа называется удельной. Для неё имеем:
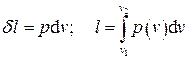 . (1.24)
. (1.24)
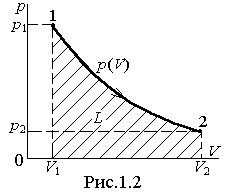 |
Работа (полная L или удельная l) может быть изображена графически в системе прямоугольных координат (p - v) площадью под кривой p (v), что следует из геометрического смысла определённого интеграла (рис.1.2).
При вычислении количества теплоты уже нет возможности опираться на механику. По сложившейся традиции количество теплоты определяют как величину, пропорциональную изменению температуры системы:
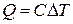 . (1.25)
. (1.25)
Величина C (с размерностью в системе единиц СИ Дж/К) носит название теплоёмкости термодинамической системы. Теплоёмкость C может принимать самые различные значения от 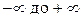 . Известно, что температуру тела можно увеличить, не подводя к нему теплоту, например, ударяя по нему, и можно поддерживать постоянной, отводя или подводя теплоту, например, поместив сжимаемый или расширяющийся газ в термостат. В общем случае теплоёмкость термодинамической системы C зависит от количества вещества, составляющего систему; от вида вещества; от состава смеси, если система представляет собой смесь нескольких компонентов; от агрегатного состояния вещества; от температуры; от давления и, как уже говорилось, от способа изменения состояния системы, т.е. от процесса. Теплоёмкость термодинамической системы, отнесённая к единице количества вещества системы, носит название удельной теплоёмкости. При этом из соображений удобства в зависимости от выбора единицы количества вещества вводят различные удельные теплоёмкости:
. Известно, что температуру тела можно увеличить, не подводя к нему теплоту, например, ударяя по нему, и можно поддерживать постоянной, отводя или подводя теплоту, например, поместив сжимаемый или расширяющийся газ в термостат. В общем случае теплоёмкость термодинамической системы C зависит от количества вещества, составляющего систему; от вида вещества; от состава смеси, если система представляет собой смесь нескольких компонентов; от агрегатного состояния вещества; от температуры; от давления и, как уже говорилось, от способа изменения состояния системы, т.е. от процесса. Теплоёмкость термодинамической системы, отнесённая к единице количества вещества системы, носит название удельной теплоёмкости. При этом из соображений удобства в зависимости от выбора единицы количества вещества вводят различные удельные теплоёмкости:
- массовая теплоёмкость
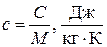 , (1.26)
, (1.26)
- объёмная теплоёмкость
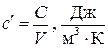 , (1.27)
, (1.27)
- мольная теплоёмкость
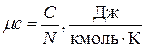 . (1.28)
. (1.28)
Как бы ни была выбрана удельная теплоёмкость, все они, очевидно, должны удовлетворять условию 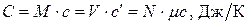 .
.
Количество теплоты, отнесённое к единице массы системы, называется удельной теплотой:
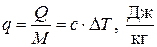 . (1.29)
. (1.29)
Теплоёмкость системы, определённая в (1.25) (или удельные теплоёмкости, определённые в (1.26) – (1.28)), представляет собой среднюю теплоёмкость в интервале температур Δ T = T 2– T 1. При учёте зависимости теплоёмкости от температуры её следует определять как отношение бесконечно малого количества теплоты к бесконечно малому изменению температуры, т.е.
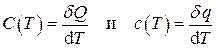 . (1.30)
. (1.30)
Определённые таким образом теплоёмкости называются истинными при данной температуре (строго говоря, в окрестности около данной температуры).
Имеем тогда для количеств теплоты:
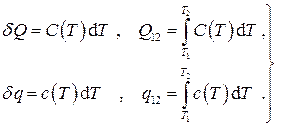 (1.31)
(1.31)
Для удобства в инженерных расчётах выражение для количества теплоты обычно записывается в более простой форме, в частности,
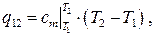 (1.32)
(1.32)
где 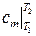 есть средняя удельная теплоёмкость в интервале температур (
есть средняя удельная теплоёмкость в интервале температур (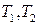 ), определяемая по теореме о среднем как
), определяемая по теореме о среднем как
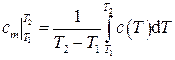 . (1.33)
. (1.33)
Замечание. Во всех формулах, начиная с (1.25), можно, очевидно, заменить температуру T, измеряемую в кельвинах, на температуру t, измеряемую в стоградусной международной шкале, т.е. в оС, так как количество теплоты и теплоёмкость определены только для разностей температур, которые в кельвинах и в градусах Цельсия совпадают.
Идеальный газ
Наиболее распространёнными веществами, используемыми в современных тепловых двигателях в качестве рабочих тел, являются атмосферный воздух и вода. Это связано, во-первых, с их большой распространённостью в природе и, во-вторых, с их относительно малой агрессивностью по отношению к конструкционным материалам. Этим объясняется большое количество экспериментальных данных по теплофизическим свойствам воздуха и воды.
Результаты опытных данных по свойствам воздуха и других газов при условиях, близких к атмосферным, были обобщены в виде газовых законов, носящих имена учёных, внесших наибольший вклад в эти исследования.
1. Закон Бойля - Мариотта
В 1661 году английский физик Р.Бойль и в 1676 году французский физик Э.Мариотт экспериментально установили обратно пропорциональную зависимость давления воздуха и других газов от объёма при постоянной температуре, что математически записывается в виде
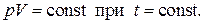 (1.34)
(1.34)
2. Закон Гей-Люссака.
Французский физик и химик Ж.Л.Гей-Люссак в 1802 году на основании опытных данных установил линейную зависимость объёма газов от температуры при постоянном давлении, т.е.
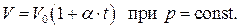 (1.35)
(1.35)
Постоянная 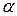 оказалась одинаковой для всех исследованных газов и по современным данным составляет
оказалась одинаковой для всех исследованных газов и по современным данным составляет
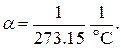 (1.36)
(1.36)
Закон Шарля
В 1787 году французский физик Ж.А.Ц.Шарль установил закон изменения давления газов с изменением температуры при постоянном объёме. Этот закон, так же, как и закон Гей-Люссака, описывается линейной зависимостью давления от температуры
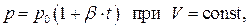 (1.37)
(1.37)
причём постоянная 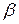 практически совпадала с постоянной
практически совпадала с постоянной 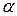 в законе Гей-Люссака. Позднее более точные измерения показали, что эти постоянные одинаковы.
в законе Гей-Люссака. Позднее более точные измерения показали, что эти постоянные одинаковы.
Закон Авогадро
Этот закон, сформулированный итальянским физиком и химиком А.Авогадро в 1811 году, гласит: при одинаковых температурах и давлениях одинаковые объёмы любых газов содержат одно и то же число молекул. Исходя из сформулированного им же закона о пропорциональности объёмов и масс вступающих в химическую реакцию газов, Авогадро удалось также вычислить число молекул, содержащихся в одном киломоле любого газа, так называемую постоянную (или число) Авогадро:
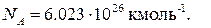
В терминах макроскопических параметров закон Авогадро формулируется следующим образом: один киломоль любого газа при нормальных физических условиях занимает один и тот же объём, равный 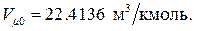
За нормальные физические условия (НФУ) принимаются стандартные значения давления и температуры, близкие к обычным атмосферным условиям в средних широтах северного полушария:
НФУ: 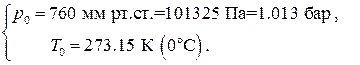 (1.38)
(1.38)
Перечисленные выше газовые законы позволяют записать термическое уравнение состояния для газов. Для этого запишем полный дифференциал объёма V системы как функции двух независимых переменных – давления p и температуры t:
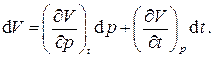
Частные производные, входящие в это выражение, легко находятся из математических записей законов Бойля - Мариотта и Гей-Люссака:
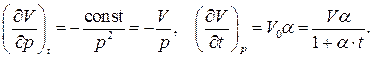
Подставляя эти частные производные в дифференциал объёма 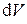 и разделив его на V, получим дифференциальное уравнение для V с разделёнными переменными
и разделив его на V, получим дифференциальное уравнение для V с разделёнными переменными
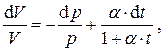
решение которого есть
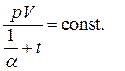 (1.39)
(1.39)
Величина 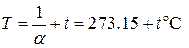 представляет собой температуру, нулевое значение которой по шкале Цельсия соответствует -273.15оС. Такая температурная шкала была предложена В.Кельвином и носит название абсолютной. Таким образом, решение (1.39) может быть написано в виде объединённого закона газового состояния
представляет собой температуру, нулевое значение которой по шкале Цельсия соответствует -273.15оС. Такая температурная шкала была предложена В.Кельвином и носит название абсолютной. Таким образом, решение (1.39) может быть написано в виде объединённого закона газового состояния
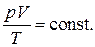 (1.40)
(1.40)
Это равенство неточное, так как оно получено на основании экспериментов и применимо в условиях, сравнительно близких к атмосферным.
Гипотетический газ, в точности подчиняющийся термическому уравнению состояния (1.40), называется идеальным. Это есть термодинамическое определение идеального газа. С молекулярно-кинетической точки зрения идеальным газом называется совокупность большого числа (порядка числа Авогадро) хаотически движущихся не взаимодействующих между собой материальных точек.
Произвольная постоянная в уравнении состояния идеального газа (1.40) может быть найдена с использованием закона Авогадро. В самом деле, если уравнение (1.40) справедливо для любого состояния идеального газа, значит, оно справедливо и для состояния при нормальных физических условиях (НФУ). Таким образом, можно написать
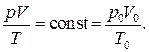 (1.41)
(1.41)
Объём данной массы газа M может быть выражен через его мольный объём
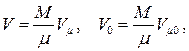
где 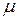 есть молекулярная (молярная) масса газа, а
есть молекулярная (молярная) масса газа, а 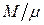 – число киломолей газа. Подставляя объём V 0 в (1.41), получаем
– число киломолей газа. Подставляя объём V 0 в (1.41), получаем
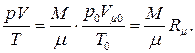 (1.42)
(1.42)
Комплекс
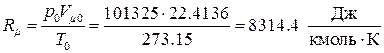 (1.43)
(1.43)
называется универсальной газовой постоянной. Таким образом, термическое уравнение состояния для идеального газа принимает вид
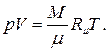 (1.44)
(1.44)
Это уравнение носит название уравнения Менделеева - Клапейрона и весьма широко используется во многих разделах физики и в технике.
Отношение
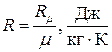 (1.45)
(1.45)
называется газовой постоянной для данного газа. С использованием этой величины
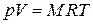 . (1.46)
. (1.46)
Уравнение состояния удобно записывать для одного килограмма газа, используя понятие удельного объёма
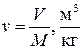 . (1.47)
. (1.47)
В этом случае уравнение состояния имеет вид
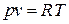 (1.48)
(1.48)
или
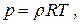 (1.49)
(1.49)
где 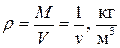 – плотность газа.
– плотность газа.
Термическое уравнение состояния позволяет найти связь между различными термическими коэффициентами, характеризующими упругие и термические свойства газов. Для идеального газа эти коэффициенты легко выражаются через параметры:
· температурный коэффициент расширения
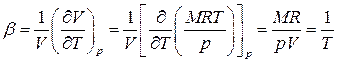 , (1.50)
, (1.50)
· изотермический коэффициент упругости
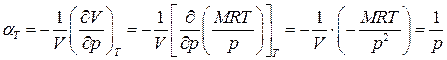 , (1.51)
, (1.51)
· коэффициент давления
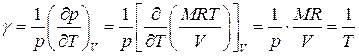 . (1.52)
. (1.52)
Для нахождения связи между этими тремя коэффициентами воспользуемся общей формулой (1.11), положив в ней 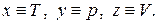 Тогда получаем
Тогда получаем
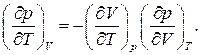 (1.53)
(1.53)
Используя определения термических коэффициентов (1.50) – (1.52), находим искомую связь:
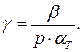 (1.54)
(1.54)
 2017-10-25
2017-10-25 1040
1040
