Задачей термодинамической теории смесей газов является вычисление свойств и параметров смеси по заданным свойствам и параметрам компонентов смеси и её составу. Мы будем рассматривать равновесные смеси идеальных нереагирующих газов, состав которых не изменяется в процессах смешения и изменения их термодинамического состояния.
Пусть в некотором объёме V находится смесь n химически различных идеальных газов при давлении p и температуре T. И пусть для каждого из компонентов известны их массы Mi и химические формулы (молярные массы μi), i = 1,2,3,…, n. Так как каждый из компонентов смеси, по предположению, является идеальным газом и ведёт себя независимо от присутствия других газов, то для каждого из них можно записать термическое уравнение состояния
 (1.55)
(1.55)
где учтено, что каждый из компонентов смеси занимает весь её объём.
Величина pi носит название парциального давления i –го компонента в смеси и имеет смысл давления, которое имел бы этот компонент, занимая весь объём смеси при температуре смеси.
Просуммировав (1.55) по всем компонентам смеси, получим
 (1.56)
(1.56)
Согласно известному закону Дальтона, сумма парциальных давлений компонентов смеси идеальных газов равна полному давлению смеси, т.е.
 (1.57)
(1.57)
С другой стороны, смесь идеальных газов, очевидно, должна описываться уравнением состояния Менделеева–Клапейрона  , где под R следует понимать некоторую эффективную, "кажущуюся", газовую постоянную смеси, а масса смеси M равна, очевидно, сумме масс компонентов. Таким образом, (1.56) с учётом закона Дальтона запишется в виде
, где под R следует понимать некоторую эффективную, "кажущуюся", газовую постоянную смеси, а масса смеси M равна, очевидно, сумме масс компонентов. Таким образом, (1.56) с учётом закона Дальтона запишется в виде 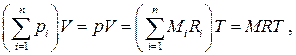 откуда находим
откуда находим

По определению, отношение
 (1.58)
(1.58)
называется массовой долей i –го компонента в смеси, причём закон сохранения массы приводит к условию
 (1.59)
(1.59)
т.е. независимыми являются лишь n -1 массовых долей компонентов.
Таким образом, кажущаяся газовая постоянная смеси с учётом определения массовых долей (1.58) вычисляется следующим образом:
 . (1.60)
. (1.60)
Кажущаяся молекулярная масса смеси вычислится тогда по определению (1.45)
 (1.61)
(1.61)
На практике чаще задаётся не массовый состав смеси (1.58), а объёмный, определяемый набором объёмных долей компонентов
 (1.62)
(1.62)
где величины Vi представляют собой так называемые приведённые объёмы. Приведённый объём i –го компонента имеет смысл объёма, который занимал бы этот компонент при давлении и температуре смеси. Согласно этому определению, приведённый объём вычисляется следующим образом:
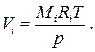 (1.63)
(1.63)
Из закона Дальтона следует тогда
 т.е.
т.е.  (1.64)
(1.64)
В химии состав смеси часто задаётся так называемыми мольными долями, определяемыми отношениями
 (1.65)
(1.65)
где Ki – число киломолей i –го компонента; K – полное число киломолей смеси. Поскольку, согласно закону Авогадро, одинаковое число киломолей любого идеального газа занимают одинаковый объём, отсюда следует равенство мольных и объёмных долей, т.е.
 (1.66)
(1.66)
Приведём ещё одно полезное соотношение, справедливое для идеальных газов и следующее из (1.62) и (1.64):
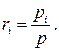 (1.67)
(1.67)
Очевидно, что между массовыми и объёмными долями компонентов в смеси должна существовать однозначная связь. Найдём её, используя определение массовой доли (1.58) и соотношение (1.67):
 . (1.68)
. (1.68)
Обратная связь находится из определения объёмных долей (1.62) и массовой доли (1.58):
 . (1.69)
. (1.69)
Умножив это выражение на μi и просуммировав по i с учётом (1.59) и (1.61), получим полезные соотношения:
 . (1.70)
. (1.70)
К следующему занятию курсанты должны:
ЗНАТЬ: термическое уравнение состояния; методы вычисления количеств работы и теплоты.
УМЕТЬ: применять математический аппарат термодинамики.
ИМЕТЬ ПРЕДСТАВЛЕНИЕ: об истории развития термодинамики и ученых, внесших наибольший вклад в это развитие; об основных параметрах состояния термодинамической системы.
Задания на самоподготовку:
· конспект лекций
· задача на термическое уравнение состояния идеальных газов
Подпись автора
_____________/ профессор каф. физики и теплообмена П.В. Скрипов
Лекция рассмотрена и одобрена на заседании кафедры
Протокол №_______ от «_____»_____________ 2006 г.
Зав. кафедрой физики и теплообмена
профессор, д.т.н. __________________ / Н.М. Барбин
«_____»______________ 2006 г.
 2017-10-25
2017-10-25 1054
1054