МИНИСТЕРСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ
ПО ДЕЛАМ ГРАЖДАНСКОЙ ОБОРОНЫ,
ЧРЕЗВЫЧАЙНЫМ СИТУАЦИЯМ И ЛИКВИДАЦИИ ПОСЛЕДСТВИЙ
СТИХИЙНЫХ БЕДСТВИЙ
УРАЛЬСКИЙ ИНСТИТУТ ГОСУДАРСТВЕННОЙ ПРОТИВОПОЖАРНОЙ СЛУЖБЫ
Кафедра физики и теплообмена
Дисциплина:
ТЕПЛОТЕХНИКА
Л Е К Ц И Я
ТЕМА 5. ФАЗОВЫЕ ПЕРЕХОДЫ. ПРОЦЕССЫ ВОДЯНОГО ПАРА
Автор:
д.ф.-м.н., профессор П.В. Скрипов
Екатеринбург 2006
Цели лекции:
Учебные: Сформировать представление об основных условиях термодинамического равновесия и дать концепцию термодинамики фазовых переходов; познакомить с методом термодинамических потенциалов и процессами водяного пара.
Воспитательные: Воспитывать стремление к углубленному изучению предмета; прививать убежденность в практической значимости получаемых в лекционном курсе знаний.
Развивающие: Развивать способность творчески воспринимать и конспектировать предоставляемый материал; развивать навыки самостоятельной аналитической работы, умение выделять главное, проводить сопоставление и обобщение.
Метод проведения: лекция
Время занятия: 160 минут
Место проведения: аудитория
Материальное обеспечение: раздаточный материал с представлением основных соотношений и графиков
ЛИТЕРАТУРА:
1. Теплотехника: Учебник для вузов / А.П. Баскаков, Б.В. Берг, О.К. Витт и др.; под ред. А.П. Баскакова. 2-е изд., перераб. – М.: Энергоатомиздат, 1991. 224 с.
2. Техническая термодинамика: Учебное пособие / В.Н.Королёв, Е.М.Толмачёв. Екатеринбург: УГТУ, 2001. 180 с.
ПЛАН ЛЕКЦИИ:
1. Введение. Термодинамика фазовых переходов.
2. Уравнение Гиббса.
3. Характеристические функции. Термодинамические потенциалы.
4. Условия термодинамического равновесия однофазной системы.
6. Условия термодинамического равновесия многофазных систем.
7. Фазовый переход "жидкость - пар".
8. Формула Клапейрона – Клаузиуса.
9. Параметры влажного пара.
10. Процессы водяного пара. Диаграмма 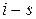 .
.
Уравнение Гиббса
Первое и второе начала термодинамики и математические свойства дифференциалов теплоты, работы, внутренней энергии, энтальпии, энтропии позволяют развить математически строгий формализм исследования термодинамических свойств веществ и процессов изменения их состояния. Начала термодинамики могут быть записаны совместно в одной из форм:
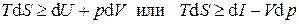 , (5.1)
, (5.1)
где знак равенства относится к обратимым процессам, а знак неравенства - к необратимым. В случае обратимых процессов эти соотношения носят название термодинамических тождеств или фундаментальных уравнений Гиббса:
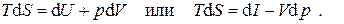 (5.2)
(5.2)
Из уравнений Гиббса можно получить несколько весьма важных для практических целей результатов. Запишем для этого (5.2) в виде
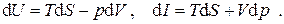 (5.3)
(5.3)
Применив к этим выражениям преобразование Лежандра по переменным 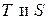 , т.е. имея в виду, что
, т.е. имея в виду, что 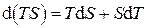 , получим
, получим

Новые функции состояния
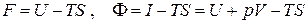 (5.4)
(5.4)
носят названия свободной энергии Гельмгольца (F) и свободной энергии Гиббса ( Φ ). Имеем, таким образом, ещё две дифференциальные формы:
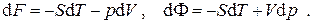 (5.5)
(5.5)
Так как (5.3) и (5.5) есть полные дифференциалы функций двух переменных 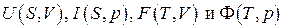 , то из сравнения коэффициентов при дифференциалах независимых переменных получаем соотношения, связывающие частные производные от функций, характеризующих термодинамическую систему, по одним независимым переменным с другими независимыми переменными:
, то из сравнения коэффициентов при дифференциалах независимых переменных получаем соотношения, связывающие частные производные от функций, характеризующих термодинамическую систему, по одним независимым переменным с другими независимыми переменными:
 (5.6)
(5.6)
Характеристические функции
Каждая из функций 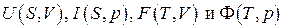 носит название характеристической функции, а пара независимых переменных при них называется естественной парой переменных параметров для соответствующей характеристической функции. Все они, естественно, однозначно связаны друг с другом в соответствии с их определением (5.4).
носит название характеристической функции, а пара независимых переменных при них называется естественной парой переменных параметров для соответствующей характеристической функции. Все они, естественно, однозначно связаны друг с другом в соответствии с их определением (5.4).
Характеристические функции играют важную роль в исследовании термодинамических систем, так как знание их позволяет вычислять термодинамические параметры вещества простым дифференцированием. Сами же характеристические функции находятся либо экспериментальным путём, либо теоретически с помощью методов статистической физики.
Далее, из того факта, что дифференциалы характеристических функций являются полными, следует равенство перекрёстных производных:
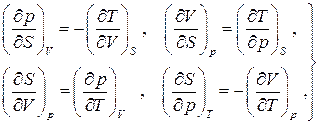
 (5.7)
(5.7)
называемых соотношениями Максвелла. Эти соотношения позволяют сводить нахождение трудно измеримых в опыте производных к относительно просто измеримым. В дальнейшем мы воспользуемся ими при исследовании свойств водяного пара.
 2017-10-25
2017-10-25 1209
1209







