Рассмотрим термодинамику систем, в которых могут иметь место фазовые переходы. Вначале дадим несколько необходимых определений.
- Термодинамическая система, которая может обмениваться веществом с окружающей средой, называется открытой.
- Термодинамическая система называется однородной или гомогенной, если в каждой малой её части физические свойства вещества и интенсивные термодинамические параметры одинаковы или если они меняются в пространстве, занятом системой, то непрерывным образом.
- Термодинамические системы, в которых физические свойства вещества и/или интенсивные параметры меняются скачкообразно на некоторых поверхностях внутри системы, называются гетерогенными. Примером гетерогенной системы является кипящая жидкость.
- Области в гетерогенной системе с однородными или непрерывно изменяющимися свойствами и параметрами называются фазами. Очевидно, что при равновесии гетерогенной системы в отсутствие внешних полей интенсивные параметры в пределах каждой фазы являются постоянными.
Но в различных фазах эти интенсивные параметры не обязаны быть одинаковыми. Гомогенная система является, таким образом, однофазной.
- Каждая из фаз в общем случае может представлять собой гомогенную смесь химически чистых веществ, между которыми возможны химические реакции. Химически чистые вещества в смеси называются компонентами. Фазы в общем случае могут обмениваться не только энергией в форме работы и/или теплоты, но и веществом. Превращение вещества из одного фазового состояния в другое называется фазовым переходом.
Пусть однокомпонентная однофазная термодинамическая система является открытой, причём только вещество, составляющее эту систему, может проникать через оболочку. И пусть система является однородной и равновесной.
Изменение внутренней энергии такой системы будет происходить не только вследствие подвода теплоты и совершения над ней работы, но также и вследствие изменения её массы. Вещество, проникающее через оболочку, несёт присущую ему энергию. Тогда уравнения Гиббса для каждого из четырёх термодинамических потенциалов (5.3) и (5.5) следует дополнить ещё одним слагаемым, пропорциональным изменению массы системы, т.е.
 (6.1)
(6.1)
Величина μ, определяемая, согласно свойствам полных дифференциалов, частными производными
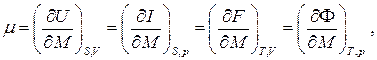 (6.2)
(6.2)
носит название химического потенциала и имеет смысл изменения энергии термодинамической системы при изменении её массы на единицу при поддержании постоянной той или иной пары независимых термодинамических параметров системы.
Найдём связь химического потенциала с другими термодинамическими потенциалами системы. Для этого рассмотрим четвёртое из выражений (6.1). Свободную энергию Гиббса Φ, энтропию S и объём системы V запишем через их удельные величины:
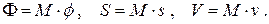
Заменяя дифференциал свободной энергии Гиббса его выражением 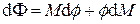 и перегруппировав слагаемые, получим
и перегруппировав слагаемые, получим

Но согласно (5.5) для M = const = 1 кг  , откуда, ввиду произвольности дифференциала массы d M, находим
, откуда, ввиду произвольности дифференциала массы d M, находим
 (6.3)
(6.3)
т.е. химический потенциал вещества есть его удельная свободная энергия Гиббса. Для идеального газа, используя выражения для энтальпии (3.) и энтропии (3.), химический потенциал получим в виде
 (6.4)
(6.4)
5.7. Условия термодинамического равновесия многофазных систем. Правило фаз Гиббса
Рассмотрим однокомпонентную систему, состоящую из двух взаимодействующих фаз. Пусть каждая из фаз находится в своём внутреннем равновесии, т.е. каждая из них характеризуется своим набором интенсивных и экстенсивных параметров. Изучим вопрос о равновесии между фазами системы. Для этого заключим всю систему в изолирующую оболочку (рис.5.1). Тогда при малом изменении состояния каждой из фаз (подсистем) можно записать для них термодинамические тождества в соответствии с (6.1)
 (6.5)
(6.5)
В силу аддитивности экстенсивных величин  , замкнутости системы и обратимости процесса имеем
, замкнутости системы и обратимости процесса имеем

т.е. после почленного суммирования равенств (6.5) получаем

В силу произвольности дифференциалов  множители в скобках при этих дифференциалах должны быть равны нулю, откуда получаем условия термодинамического равновесия двухфазной однокомпонентной системы:
множители в скобках при этих дифференциалах должны быть равны нулю, откуда получаем условия термодинамического равновесия двухфазной однокомпонентной системы:
 (6.6)
(6.6)
Химический потенциал по определению сам является функцией "естественной" пары переменных  , таким образом, условие равновесия фаз может быть записано в виде
, таким образом, условие равновесия фаз может быть записано в виде
 (6.7)
(6.7)
Вид функций  от T и p в общем случае различен для каждой из фаз, поэтому условие (6.7) не является тождеством. Это есть алгебраическое уравнение, связывающее температуру и давление в равновесной системе, состоящей из двух сосуществующих взаимодействующих фаз, между которыми имеет место обмен теплотой, работой и веществом.
от T и p в общем случае различен для каждой из фаз, поэтому условие (6.7) не является тождеством. Это есть алгебраическое уравнение, связывающее температуру и давление в равновесной системе, состоящей из двух сосуществующих взаимодействующих фаз, между которыми имеет место обмен теплотой, работой и веществом.
Таким образом, в двухфазной однокомпонентной системе температура и давление однозначно связаны. Объём же системы может принимать произвольное значение в зависимости от соотношения между массами фаз. Состояние равновесия двухфазной системы называется состоянием насыщения, а равные для фаз температура и давление - параметрами насыщения T s, p s.
Рассмотрим аналогичным образом равновесие трёхфазной однокомпонентной системы. Имеем в данном случае:
 (6.8)
(6.8)
Но для замкнутой системы

с учётом чего, складывая почленно (6.8), получаем

Так как все дифференциалы здесь независимы и значения их произвольны, находим условия равновесия:
 (6.9)
(6.9)
Химическое равновесие, т.е. равенство химических потенциалов фаз, может быть записано в виде двух алгебраических уравнений
 (6.10)
(6.10)
Это есть система двух уравнений с двумя неизвестными  . Равновесная однокомпонентная система может существовать одновременно в виде трёх фаз только при строго определённых значениях давления и температуры. Такое состояние системы называется тройной точкой.
. Равновесная однокомпонентная система может существовать одновременно в виде трёх фаз только при строго определённых значениях давления и температуры. Такое состояние системы называется тройной точкой.
Для равновесной четырёхфазной однокомпонентной системы получим
 (6.11)
(6.11)
систему трёх уравнений с двумя неизвестными. Такая система уравнений является несовместной за исключением случая, когда любые два из них пропорциональны друг другу, т.е. когда две из четырёх фаз фактически неразличимы, а это уже будет трёхфазная система. Таким образом, в равновесной однокомпонентной системе возможно одновременное сосуществование не более чем трёх фаз. Если равновесная термодинамическая система является многокомпонентной, то число одновременно сосуществующих фаз может быть больше трёх, а именно
 (6.12)
(6.12)
где n есть число компонентов системы. Этот результат носит название правила фаз Гиббса.
 2017-10-25
2017-10-25 2419
2419








