Модуль 4. Окисно-відновні реакції та електрохімічні процеси
| Розділ 4.1. Окисно-відновні реакції…………………..………………………… |
| Розділ 4.2. Електрохімічні процеси....................................................................... |
| 4.2.1. Електрохімічні поняття. Електродний потенціал................................. |
| 4.2.2.Хімічні джерела електричної енергії……………………………....... 4.2.2.1. Гальванічні елементи………………………..………………………. 4.2.2.2. Акумулятори…………………………….…………………………… 4.2.2.3. Паливні елементи…………………………………………………... |
| Розділ 4.3. Електроліз…………………………………………………………….. |
| Розділ 4.4. Корозія металів. Методи захисту від корозії………………………. |
Розділ 4.1. Окисно-відновні реакції
Ступінь окиснення – це умовний заряд атома в молекулі, обчислений у припущенні, що молекула складається з йонів і в цілому електронейтральна (у ряді випадків ступінь окиснення не збігається з валентністю).
Розрахунок ступеня окиснення
Для обчислення ступеня окиснення елемента слід ураховувати наступні положення:
1. Ступінь окиснення атомів у простих речовинах дорівнює нулю ( ,
,  ).
).
2. Алгебраїчна сума ступенів окиснення всіх атомів, що входять до складу молекули, завжди дорівнює нулю, а в складному йоні ця сума дорівнює заряду йона.
3. Постійний ступінь окиснення мають атоми: лужних металів (+1), лужноземельних металів (+2), Гідрогену (+1) (крім гідридів NaH, CaH2 тощо, де ступінь окиснення Гідрогену –1), Оксигену (–2) (крім F2O і пероксидів, що містять групу –O–O–, у якій ступінь окиснення Оксигену –1).
4. Для елементів позитивний ступінь окиснення не може перевищувати величину, яка дорівнює номеру групи періодичної системи. Наприклад:  ;
;  ;
;  ;
;  ;
; 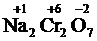 .
.
Реакції, які супроводжуються зміною ступенів окиснення елементів, називаються окисно-відновними реакціями. Окиснення – процес віддачі електронів атомами, йонами або молекулами, внаслідок чого ступінь окиснення елементів, що втратили електрони, зростає:
 – 2ē → 2
– 2ē → 2  ;
;  – 2ē →
– 2ē →  ;
;  – 3ē →
– 3ē →  ;
;
 – ē →
– ē →  ; 2
; 2 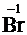 – 2ē →
– 2ē →  .
.
Відновлення – процес приєднання електронів атомами, йонами або молекулами, внаслідок чого ступінь окиснення елементів, що приєднали електрони, зменшується:
 + 2ē →
+ 2ē → 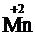 ;
;  + 2ē →
+ 2ē →  ;
;  + 3ē →
+ 3ē →  ;
;
 +2ē → 2
+2ē → 2  ;
;  + 4ē → 2
+ 4ē → 2  .
.
Речовини, що в окисно-відновних реакціях втрачають електрони, називаються відновниками, а речовини, що приєднують електрони, – окисниками. Найважливіші окисники й відновники наведені в табл. 4.1.
Таблиця 4.1
 2017-12-14
2017-12-14 613
613







