Корозія – це окисно-відновний процес руйнування металів у результаті їх фізико-хімічної взаємодії з навколишнім середовищем, який протікає самодовільно. Залежно від природи хімічних процесів, які лежать в основі руйнування металу, розрізняють такі типи корозії: хімічну, електрохімічну та електричну.
Хімічна корозія проходить у відсутності електроліту під дією навколишнього середовища, температури. Вона поділяється на газову, високотемпературну й корозію в неводних середовищах.
Хімічна активність більшості металів за їх відношенням до кисню за високих температур майже необмежена, оскільки оксиди всіх технічно важливих металів здатні розчинятися в металах і „виходити” із рівноважної системи:
2Ме(т) + О2(г) ⇄ 2МеО(т); МеО(т) ⇄[ МеО] (розчин).
Одночасно з розчиненням оксиду може утворюватися такий оксидний шар на поверхні металу, який здатний гальмувати процес окиснення.
Швидкість окиснення металу залежить як від швидкості власне хімічної реакції, так і від швидкості дифузії окисника через плівку сполук металів (оксидів, гідроксидів). Тому захисна дія плівки тим вища, чим краща її суцільність, і нижча дифузійна здатність. Суцільність та щільність плівки, що утворюється на металі, можна оцінити за співвідношенням об’єму оксиду чи іншої сполуки, що утворюється 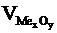 , до об’єму, витраченого на утворення цих сполук металу
, до об’єму, витраченого на утворення цих сполук металу 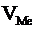 . Це співвідношення називають фактором Піллінга-Бедвордса й позначають літерою
. Це співвідношення називають фактором Піллінга-Бедвордса й позначають літерою 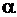 :
:
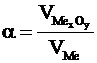 . (4.13)
. (4.13)
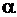 для різних металів наведено в таблице 4.3.
для різних металів наведено в таблице 4.3.
Таблиця 4.3
 2017-12-14
2017-12-14 479
479








