1. Міжмолекулярні окисно-відновні реакції. Окисник і відновник знаходяться в різних речовинах; обмін електронами в цих реакціях відбувається між різними атомами чи молекулами:
 +
+  ®
®  ;
;  +
+  ®
®  +
+  .
.
S – відновник; O2 – окисник CO – відновник; Cu – окисник
 + 2HCl ®
+ 2HCl ®  Cl2 +
Cl2 +  ↑
↑
Zn – відновник; HСl – окисник
 O2 +
O2 +  + 2H2SO4 ®
+ 2H2SO4 ®  + K2SO4 +
+ K2SO4 + 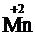 SO4 + 2H2O.
SO4 + 2H2O.
KI – відновник; MnO2 – окисник.
До міжмолекуля рних окисно-відновних процесів відносяться реакції між речовинами, у яких атоми того самого елемента мають різні ступені окиснення:
2H2  + H2
+ H2  O3 ® 3
O3 ® 3  + 3H2O.
+ 3H2O.
2. Внутрімолекулярні окисно-відновні реакції. У внутрімолекулярних реакціях окисник і відновник знаходяться в одній і тій же молекулі. Внутрімолекулярні реакції протікають, як правило, при термічному розкладі речовин, що містять окисник і відновник.
2K 
 3 –t°® 2K
3 –t°® 2K  + 3
+ 3  ↑;
↑;  – окисник;
– окисник;  – відновник.
– відновник.
 H4
H4  O3 –t°®
O3 –t°®  O↑ + 2H2O;
O↑ + 2H2O;  – окисник;
– окисник;  – відновник.
– відновник.
2Pb(
 )2 –t°® 2PbO + 4
)2 –t°® 2PbO + 4  O2 +
O2 +  ↑;
↑;  –окисник;
–окисник;  – відновник.
– відновник.
3. Диспропорціонування (самоокиснення-самовідновлення) – окисно-відновна реакція, у якій один елемент одночасно підвищує й знижує ступінь окиснення.
 + 2KOH ® K
+ 2KOH ® K  O + K
O + K  + H2O;
+ H2O;
3K2  O4 + 2H2O ® 2K
O4 + 2H2O ® 2K  O4 +
O4 +  O2 + 4KOH;
O2 + 4KOH;
2  O2 + 2KOH ® K
O2 + 2KOH ® K  O3 + K
O3 + K  O2 + H2O.
O2 + H2O.
Визначити можливість перебігу і напрямок окисно-відновних реакцій можна на основі окисно-відновних потенціалів. Умовою здійснення таких реакцій є позитивне значення електрорушійної сили.
Розділ 4.2. Електрохімічні процеси
 2017-12-14
2017-12-14 445
445








