Електрохімія – розділ хімії, у якому вивчають закономірності взаємного перетворення електричної та хімічної енергії. Подібні перетворення здійснюються в електрохімічних системах, складовими частинами яких є:
1) електроліт, який забезпечує проходження електричного струму (провідник другого роду) і містить речовини, здатні окиснюватися або відновлюватися на електродах;
2) електроди, що забезпечують контакт із електролітом та обмін електронами з учасниками реакції;
3) зовнішній ланцюг (провідник першого роду) – металічний провідник, який з’єднує електроди.
Електрохімічні реакції є окисно-відновними гетерогенними реакціями, які перебігають на електродах, тобто на межі поділу двох фаз.
При зануренні металічної пластинки у воду під впливом її полярних молекул катіони металу переходять до рідкої фази. Металічна поверхня набуває негативного заряду, який створюється залишеними на ній електронами. Унаслідок цього виникає електростатичне притягання між йонами, які перейшли в розчин, і поверхнею металу, що має протилежний заряд. Це перешкоджає подальшому перебігу процесу йонізації і викликає зворотний процес – відновлення йонів металу. Коли швидкості йонного обміну в обох напрямках стають однаковими, в системі встановлюється рухома окисно-відновна рівновага:
Ме + mH2O ⇄ Me(H2O) 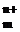 + n
+ n 
або спрощено
Ме ⇄ Me  + n
+ n  .
.
На поверхні металічної пластинки виникає подвійний електричний шар. Різницю потенціалів, яка виникає між металом та водним середовищем у стані рівноваги, називають рівноважним електродним потенціалом або потенціалом електроду.
При зануренні металу в розчин його солі також виникає подвійний електричний шар, але в цьому випадку можливі два механізми його утворення. Якщо концентрація катіонів металу в розчині не досягає рівноважної або метал досить активний, то рівновага процесу окиснення металу зміщується праворуч, металічна пластинка заряджується негативно. Якщо концентрація катіонів металу в розчині перевищує рівноважну або метал малоактивний, то рівновага зміщується ліворуч, металічна пластинка заряджується позитивно.
Різниця потенціалів, яка виникає між металом та розчином є електродним потенціалом –  . Потенціал металу в розчині його солі записують як
. Потенціал металу в розчині його солі записують як  (
( – окиснена форма металу,
– окиснена форма металу,  –відновлена форма металу, риска – поверхня розділу „розчин-метал”). Потенціалу приписують той знак, який виникає на металі в подвійному електричному шарі.
–відновлена форма металу, риска – поверхня розділу „розчин-метал”). Потенціалу приписують той знак, який виникає на металі в подвійному електричному шарі.
Величина електродного потенціалу для металічних електродів залежить від природи металу, концентрації його йонів у розчині електроліту та температури й обчислюється за рівнянням Нернста:
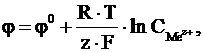 (4.1)
(4.1)
де j0 – стандартний електродний потенціал (потенціал, який виміряно за стандартних умов:  = 1 моль/л, р = 101,325 кПа, Т = 298 К); R = 8,314 Дж/(К·моль); T – абсолютна температура, К; z – заряд йону металу; F = 96485 Кл/моль, стала Фарадея;
= 1 моль/л, р = 101,325 кПа, Т = 298 К); R = 8,314 Дж/(К·моль); T – абсолютна температура, К; z – заряд йону металу; F = 96485 Кл/моль, стала Фарадея;  – концентрація йонів металу в розчині, моль/л.
– концентрація йонів металу в розчині, моль/л.
При Т = 298 К рівняння Нернста має вигляд:
 . (4.2)
. (4.2)
Абсолютне значення потенціалу окремого електрода виміряти неможливо, оскільки він реалізується в різних фазах. Його вимірюють відносно величини потенціалу іншого електрода, який називають електродом порівняння. Найчастіше для цієї мети використовують нормальний водневий електрод, для якого стандартний потенціал умовно приймають за  . Водневий електрод складається з платівки з платини або якогось іншого металу, що добре адсорбує водень, зануреної в розчин, що містить йони Гідрогену. Платина весь час омивається струменем водню. На цьому електроді протікає електродна реакція:
. Водневий електрод складається з платівки з платини або якогось іншого металу, що добре адсорбує водень, зануреної в розчин, що містить йони Гідрогену. Платина весь час омивається струменем водню. На цьому електроді протікає електродна реакція:
2Н  + 2
+ 2  ⇄ Н
⇄ Н  .
.
Потенціал нормального водневого електрода розраховується за рівнянням:
 . (4.3)
. (4.3)
У разі стандартних умов, коли  = 1 моль/л,
= 1 моль/л,  атм:
атм:
 . (4.4)
. (4.4)
Оскільки pН= –lg  , то
, то
 . (4.5)
. (4.5)
Більшість стандартних електродних потенціалів визначають експериментально. Але для лужних та лужно-земельних металів  обчислюють лише теоретично. Це пояснюється тим, що дані метали взаємодіють із водою.
обчислюють лише теоретично. Це пояснюється тим, що дані метали взаємодіють із водою.
Значення стандартних електродних потенціалів металів, що розміщені в порядку зростання, утворюють ряд, який називають рядом стандартних електродних потенціалів або електрохімічним рядом напруг (додаток 8). Стандартний електродний потенціал є мірою хімічної активності металу. Положення того чи іншого металу в електрохімічному ряді напруг характеризує відновну здатність металів та окиснювальну здатність їх йонів у водних розчинах. Чим менше алгебраїчна величина потенціалу, тим вище відновна здатність цього металу.
 2017-12-14
2017-12-14 608
608








