| Метал | Оксид | 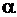
| Метал | Оксид | 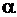
|
| Mg | MgO | 0,79 | Zn | ZnO | 1,58 |
| Pb | PbO | 1,15 | Zr | ZrO2 | 1,60 |
| Cd | CdO | 1,27 | Be | BeO | 1,67 |
| Al | Al2O3 | 1,31 | Cu | Cu2O | 1,67 |
| Sn | SnO2 | 1,33 | Cu | CuO | 1,74 |
| Nі | NiO | 1,52 | Ti | Ti2O3 | 1,76 |
| Nb | NbO | 1,57 | Cr | Cr2O3 | 2,02 |
Метали, що характеризуються значеннями 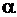 < 1, не можуть створювати суцільні та щільні оксидні плівки і, отже кисень, проникає через такі несуцільні шари (тріщини) до поверхні металу. Суцільні, щільні та стійкі оксидні плівки утворюються за умови, коли
< 1, не можуть створювати суцільні та щільні оксидні плівки і, отже кисень, проникає через такі несуцільні шари (тріщини) до поверхні металу. Суцільні, щільні та стійкі оксидні плівки утворюються за умови, коли 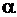 = 1,2-1,6. Однак і за більших значень
= 1,2-1,6. Однак і за більших значень 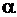 плівки іноді утворюються несуцільними та такими, що легко відділяються від поверхні металу, наприклад залізна окалина.
плівки іноді утворюються несуцільними та такими, що легко відділяються від поверхні металу, наприклад залізна окалина.
Якщо утворення оксидного шару за високої температури супроводжується інтенсивною дифузією кисню в середину металу, то це призводить до зміни його складу внаслідок окиснення легуючих компонентів. Особливо це характерно для конструкційних сталей, у поверхневих шарах яких відбувається окиснення карбону, що міститься в сталі у вигляді ферум карбіду Fe3C. Взаємодію сталей з окисними середовищами можна записати таким чином.
|
|
|
1) Під дією кисню повітря: 2Fe + O2 → 2FeO,
FeO → [FeO],
[FeO] + [Fe3C] → 4Fe + CO↑.
2) Під дією карбон (IV) оксиду: Fe + CO2 → FeO + CO,
FeO → [FeO],
Fe3C + CO2 → 3Fe + 2CO↑.
3) Під дією пари води: Fe + H2O → FeO + H2,
FeO → [FeO], H2 → 2[H],
Fe3C + H2O → 3Fe + CO↑ + H2↑.
Вміст атомів Карбону на поверхні сталі зменшується, і тверда сталь перетворюється на м’яке залізо. Третій випадок – найнебезпечніший, оскільки водень, розчиняючись у сталі створює підвищену крихкість металу.
Електрохімічна корозія пов’язана з виникненням на поверхні металу у присутності електроліту великої кількості мікроскопічних гальванічних елементів, в яких більш активний метал окиснюється, а на менш активній домішці виділяється водень або відновлюється кисень. Домішками можуть бути включення інших металів, сульфіди, оксиди і багато інших речовин, що мають достатню провідність.
Розглянемо найчастіші випадки виникнення корозійних мікроскопічних гальванопар.
1) При контактуванні будь-яких двох металів або сплавів, які перебувають у навколишньому середовищі, більш активний метал окиснюється, а на менш активному – відбувається відновлення йонів Гідрогену або молекул кисню залежно від показника рН розчину.
2) Неоднаковий рівень механічних напруг металу в одній і тій самій деталі, що породжує енергетичну неоднорідність різних ділянок металу, а отже, і різницю їхніх потенціалів.
3) При контактуванні металу і його сполуки, що має металоподібні або напівпровідникові властивості, метал, що характеризується нижчим потенціалом, окиснюється, а на неметалічних ділянках відбувається відновлення. Наприклад, корозія сталі, де включення Fe3C є катодами, а основний метал, тобто залізо, виступає в ролі анода (рис. 19); корозія внаслідок ушкодження оксидної плівки, яка є катодом гальванічного елементу, а оголена поверхня металу – анодом (рис. 20).
|
|
|
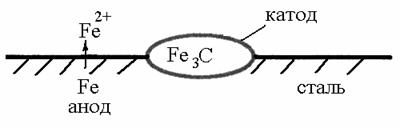
Рис. 19. Корозія сталі, яка містить включення Fe3C
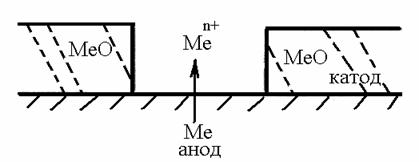
Рис. 20. Корозія внаслідок ушкодження оксидної плівки
4) При контактуванні металу із шаром (чи краплями) електроліту або повітрям, розчиненим у рідкому електроліті, якщо концентрація електролітів або розчиненого повітря різна в сусідніх ділянках цього контактування. Наприклад, корозія внаслідок різного доступу кисню до сталевої поверхні, де ділянки металічної поверхні під краплями води, у яких відсутній кисень повітря, є анодами, а більш забезпечені киснем ділянки є катодами (рис. 21).
Рис. 21. Корозія сталі внаслідок різного доступу кисню
Розглянемо електрохімічну корозію на прикладі корозії заліза в кислому, нейтральному та лужному середовищах.
У відсутності кисню:
а) якщо корозія відбувається в розчині кислоти (рН<7), то відбуваються такі реакції:
анодний процес Fe0 = Fe2+ + 2ē
катодний процес 2Н+ + 2ē = Н2
Fe0 + 2Н+ = Fe2+ + Н2.
б) якщо корозія відбувається в нейтральному та лужному середовищі (рН≥7):
анодний процес Fe0 = Fe2+ + 2ē
катодний процес 2H2O + 2ē = Н2 + 2OH–
Fe + 2H2O = Fe(OH)2 + Н2.
За наявності кисню (атмосферна):
в) якщо корозія відбувається в розчині кислоти (рН<7), то відбуваються такі реакції:
анодний процес Fe0 = Fe2+ + 2ē
катодний процес O2 + 4H+ + 4ē = 2Н2O
Fe + O2 + 4H+ = Fe2+ + 2H2O.
г) якщо корозія відбувається в нейтральному та лужному середовищі (рН≥7):
анодний процес Fe0 = Fe2+ + 2ē
катодний процес O2 + 2H2O + 4ē = 4OH–
2Fe + O2 + 2H2O = 2Fe(OH)2.
Ферум (ІІ) гідроксид, що утворюється, легко окиснюється киснем повітря: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Остання сполука частково відщеплює воду, при цьому утворюється речовина, яка за складом відповідає бурій іржі:
Fe(OH)3 → FeOOH + H2O.
Залежно від середовища розрізняють корозію в електролітах, атмосферну й ґрунтову.
Корозія в ґрунті газо-, водо- і нафтопроводів, будівельних споруд зумовлена наявністю в ґрунті кислот, інших агресивних речовин, а також кисню і води. Інтенсивність такої корозії залежить від вологості ґрунту, вмісту в ньому кисню та інших факторів. Так, металеві вироби кородують дуже швидко, якщо вміст води в ґрунті досягає 20-25 %. Якщо вологість ґрунту незначна або значно більша, ніж 30 %, то корозія уповільнюється. В останньому випадку це пояснюється зменшенням у ґрунті вмісту кисню, оскільки пори ґрунту заповнюються водою.
Електрична корозія відбувається під дією блукаючих струмів, джерелами яких є лінії електропередач, електричні залізниці, електроустановки, що працюють на постійному електричному струмі. Блукаючі струми викликають корозію газопроводів, нафтопроводів, електрокабелів, підземних металевих споруд. Ділянка конструкції, де входить струм, є катодом, а місце виходу – анодом.
Умова перебігу корозії – потенціал анодного процесу, тобто потенціал окиснення металу, повинен бути меншим, ніж потенціал процесу відновлення, який відбувається на катоді корозійного гальванічного елементу.
Швидкість електрохімічної корозії (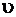 ) – найважливіша характеристика корозії, яка вимірюється одиницями маси (
) – найважливіша характеристика корозії, яка вимірюється одиницями маси (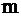 ) втраченого металу з одиниці площі (
) втраченого металу з одиниці площі (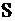 ) за одиницю часу (
) за одиницю часу (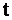 ):
):
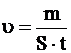 [мг/(м2·рік], [мг/(м2·год]. (4.14)
[мг/(м2·рік], [мг/(м2·год]. (4.14)
На швидкість корозії істотно впливають склад електроліту корозійного середовища і його температура. Зміна поверхні металу внаслідок корозійних процесів залежить від умов перебігу й властивостей металу. Речовини, які прискорюють корозію, називаються активаторами або стимуляторами корозії. Наприклад, хлорид-йони, розчинений у воді кисень.
|
|
|
Види корозійних пошкоджень визначають характером руйнування (рис. 22):
а) суцільна, коли корозією пошкоджена приблизно в однаковій мірі вся поверхня металу чи сплаву;
б) місцева – пошкодження локальні – можуть бути у вигляді плям або глибоких поразок, які називають виразками або крапками. Така корозія пошкоджує лише незначну частину поверхні, оскільки процес корозії поширюється головним чином у глибину металу;
в) піттінг – пошкодження проникає всередину металу;
г) селективна корозія пошкоджує не чистий метал, а металічний сплав. У хімічну взаємодію в першу чергу вступає більш активний компонент такого сплаву;
д) інтеркристалітна (міжкристалітна) корозія характеризується руйнуванням металу за межами зерен і залежить від природи металу. Їй піддаються мідні сплави (латунь, бронза) і деякі сталі.
є) транскристалітна корозія розсікає метал тріщиною крізь зерна.
Корозія металів завдає великої шкоди народному господарству. Це визначає важливість заходів, спрямованих на захист металів від корозії.
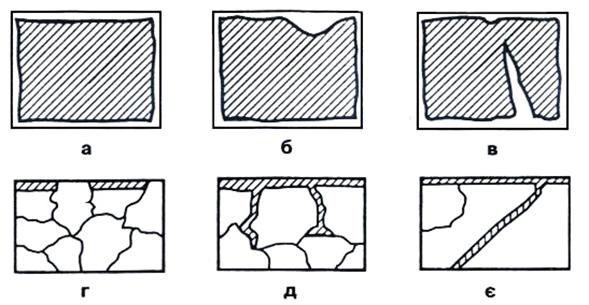
Рис. 22. Види корозійних пошкоджень: а) суцільна; б) місцева; в) піттінг; г) селективна; д) інтеркристалітна; є) транскристалітна
 2017-12-14
2017-12-14 529
529








