Как известно, центральное место в электроразрядной газоочистной установке занимают металлические иглы, которые выполняют роль электронных инжекторов, поставляющих в реакционную зону поток свободных электронов, ускоренных соответствующим электрическим полем [196–200]. Столкновение свободных электронов с молекулами реакционной зоны может сопровождаться как электронно-колебательно-вращательным возбуждением последних, так и различными видами их ионизации. Такие ситуации, в свою очередь, могут вызывать разнообразные реакции быстрых мономолекулярных превращений или стимулировать химическое взаимодействие с другими компонентами реакционной смеси в зонах различных участках активной зоны.
С этой точки зрения, с позиции теоретической химии, особый интерес должны представлять те столкновительные процессы, которые сопровождаются образованием короткоживущих интермедиатов парамагнитной природы, обусловленных либо диссоциативным «прилипанием» катодного электрона к молекуле, либо ионизацией последней при столкновении более горячей элементарной частицей. Другими словами захват электрона диамагнитной молекулой или ее ионизация электронным ударом может приводить к образованию короткоживущих анион- и катион-радикалов, т.е. парамагнитной частицей, которые уже представляют собой более реакционноспособные системы, чем исходные нейтральные молекулы. Указанные частицы, как правило, подвержены более быстрому мономолекулярному распаду, и способны инициировать все возможные бимолекулярные реакции с окружающими веществами.
Для теоретического рассмотрения этих и других физико-химических проблем газоэлектроразрядных реакций нами были проведены систематические квантово-химические исследования некоторых модельных и реальных молекулярных систем, применительно к рассматриваемой технологической установке.
В качестве методов исследования были использованы современные квантово-химические лицензионные программные пакеты: GAUSSIAN-2003, GAUSVIEW-2003, а также HYPERCHEM, CHEMOFFICE и MOPAC-7 [190–195].
Основными компонентами реакционных зон газоочистной электрической установки являются воздух, вода и другие газообразные вещества. Исходя из этого, нами, методами компьютерной химии, проведены расчеты таких важнейших физико-химических свойств молекул, как сродство к электрону и потенциалы ионизации двух атомных частиц N2, O2 — основных составляющих воздушной смеси, трехатомных молекул H2O, CO2, SO2, подвергающихся восстановлению в электроразрядном генераторе, а также молекул водорода и окиси углерода гомо- и гетероядерных двухатомных частиц, моделирующие рассматриваемые объекты.
Согласно общепринятым представлениям в теории столкновений, в зависимости от величин кинетической энергии соударяющихся частиц, в частности электрона, исходящего из игольчатого металлического катода разрядной установки и газовой молекулы реакционной системы, возможны образования, кроме различных возбужденных ровибронных состояний, короткоживущие заряженные частицы. На примере простейшей двухатомной молекулы водорода можно показать образование катион- и анион-радикалов следующего типа:
 (4.49)
(4.49)
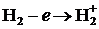 (4.49)
(4.49)
Указанные частицы  и
и 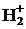 являются радикалами, то есть парамагнитными, так как содержат нечетное число электронов. Это приводит к тому, что для них становятся характерными не только реакции ионного типа, но и гомолитического присоединения и замещения. Как правило, подобные химические структуры являются короткоживущими и обладают высокой химической активностью. Принято считать, что чем меньше время жизни частицы, тем больше скорость ее гибели (аннигиляция). Аннигиляция может идти по множеству реакционных каналов, являющихся отдельными стадиями химической реакции, идущей с участием рассматриваемой частицы. Другими словами, время жизни частицы является мерой ее реакционной способности. Кроме понятия «кинетической стабильности» химической частицы, определяемой временем ее жизни, в физической химии существует термин «термодинамическая стабильность», которая определяется величиной полной энергии молекулы. Термодинамическая стабильность вещества возрастает по мере уменьшения полной энергии молекулярной структуры, которая весьма корректна, может быть рассчитана квантово-химическими методами, используемыми в данной работе.
являются радикалами, то есть парамагнитными, так как содержат нечетное число электронов. Это приводит к тому, что для них становятся характерными не только реакции ионного типа, но и гомолитического присоединения и замещения. Как правило, подобные химические структуры являются короткоживущими и обладают высокой химической активностью. Принято считать, что чем меньше время жизни частицы, тем больше скорость ее гибели (аннигиляция). Аннигиляция может идти по множеству реакционных каналов, являющихся отдельными стадиями химической реакции, идущей с участием рассматриваемой частицы. Другими словами, время жизни частицы является мерой ее реакционной способности. Кроме понятия «кинетической стабильности» химической частицы, определяемой временем ее жизни, в физической химии существует термин «термодинамическая стабильность», которая определяется величиной полной энергии молекулы. Термодинамическая стабильность вещества возрастает по мере уменьшения полной энергии молекулярной структуры, которая весьма корректна, может быть рассчитана квантово-химическими методами, используемыми в данной работе.
С квантово-химической точки зрения мерой взаимодействия свободного электрона с молекулой является величина сродства к электрону (СЭ), которая рассчитывается следующим образом:
 (4.51)
(4.51)
Другой важной характеристикой молекулы является величина потенциала ионизации (ПИ), также рассчитанная квантово-химически, и характеризующая термодинамические свойства молекулы утратившей собственный электрон в результате различных внешних воздействий, в том числе путем ионизации, обусловленной столкновением с электронами, исходящими из игольчатого электрода разрядной установки. Потенциал ионизации молекулы рассчитывается по формуле:
 , (4.52)
, (4.52)
где  — полная энергия исходной нейтральной молекулы, рассчитанная квантово-химически с полной оптимизацией ее геометрических параметров.
— полная энергия исходной нейтральной молекулы, рассчитанная квантово-химически с полной оптимизацией ее геометрических параметров.  и
и  — аналогичные энергетические величины, рассчитанные для соответствующих геометрических структур катиона и аниона [201].
— аналогичные энергетические величины, рассчитанные для соответствующих геометрических структур катиона и аниона [201].
В таблице 4.4 представлены полученные полуэмпирическим квантово-химическим методом UHF PM3, с помощью указанных расчетных формул, величины СЭ и ПИ для различных молекул, которые могут быть подвержены электроразрядным воздействиям в газоочистной установке.
Неограниченный метод Хартри-Фока был использован для корректного расчета электронных систем с открытой оболочкой, какими являются большинство приведенных ион-радикалов, а также исходные молекулы окисей азота.
Таблица 4.4
Величины сродства к электрону и потенциалы ионизации некоторых молекул, оцененные методом UHF PM3 в эВ
| Молекула | СЭ | ПИ |
| H2 | –4,173 | 15,526 |
| N2 | –0,204 | 13,794 |
| O2 | 0,720 | 11,144 |
| H2O | –3,378 | 12,037 |
| SO2 | 2,096 | 9,727 |
| CO2 | 0,450 | 12,430 |
| CO | –0,746 | 12,852 |
| NO | 0,293 | 9,693 |
| NO2 | 1,781 | 9,117 |
Следует отметить, что указанные величины СЭ и ПИ, в целом, коррелируют с аналогичными параметрами молекул, полученными разнообразными экспериментальными способами [202].
Как видно из данных, приведенных в таблице 4.4, наибольшим значением потенциала ионизации обладает молекула водорода, требующая энергию в 15,5 эВ необходимую, согласно теореме Купманса, для отрыва электрона с высшей занятой молекулярной орбитали (ВЗМО) и перевода ее в молекулярный ион водорода. Другими словами, становится очевидным тот факт, что образующийся молекулярный ион водорода на величину 15,5 эВ термодинамически менее стабилен, чем исходная электронейтральная молекула водорода. Это, в свою очередь предполагает высокую реакционную способность «горячего» катион-радикала H2+.
В ряду гетероатомных двухатомных молекул наименьшим потенциалом обладает молекула NO по сравнению с молекулой CO. Этот эффект обусловлен тем, что электронная оболочка молекулы окиси азота является открытой и на ВЗМО находится единственный неспаренный электрон, подвергающийся удалению при ионизации. Интересно отметить, что в ряду трехатомных молекул по аналогичной причине легче всего подвержена ионизации молекула двуокиси азота. В ряду гомоядерных двухатомных молекул ординарная ковалентная связь в молекуле водорода труднее подвергается ионизации, чем двойная ковалентная связь и тройная в молекулах кислорода и азота.
Сродство к электрону молекулы, представляет собой энергию, выделяемую или поглощаемую последней при присоединении к ней свободного электрона, как видно из таблицы 4.4, меняется весьма специфически. Отрицательные величины при ионизации молекул водорода, азота, воды и окиси углерода характеризуют эндотермический процесс, аналогичный процесс для молекул кислорода, двуокиси серы, двуокиси углерода и окислов азота представляется экзотермическим, те есть идущим с выделением тепла.
И в этих случаях, исходя из вышеизложенных соображений, можно полагать, что экзотермичность процесса электронного присоединения молекулами, способствующая повышению их термодинамической устойчивости, будет вызывать соответствующее понижение реакционной способности образующихся анионов.
Наблюдаемый, таким образом, экзотермический эффект процесса образования анионов, указанных молекул, объясняется квантово-химически следующим образом. Если для парамагнитных окислов азота присоединение электрона вызывает завершение заселенности высшей занятой молекулярной орбитали (ВЗМО) за счет спаривания, находящегося на ней одиночного электрона катодным электроном электроразрядной установки, то аналогичный эффект молекул кислорода и углекислого газа обусловлен специфическим вырождением МО. На рисунках 4.2 и 4.3 представлены диаграммы расположения МО электронейтральной и отрицательно заряженной молекул двуокиси углерода:

Рис. 4.2. Энергетическая диаграмма расположения и заселенностей МО молекулы двуокиси углерода, по данным UHF PM3

Рис. 4.3. Энергетическая диаграмма расположения и заселенностей МО аниона двуокиси углерода, по данным UHF PM3
На рисунках 4.4 и 4.5 приведены объемные изображения ВЗМО двуокиси углерода и его аниона, полученные с помощью петрографического драйвера квантово-химического программного пакета HYPERCHEM.

Рис. 4.4. ВЗМО молекулы двуокиси углерода

Рис. 4.5. ВЗМО аниона двуокиси углерода
Анализ разложения МО в ЛКАО, полученный квантово-химическим приближением UHF PM3 позволяет установить, что основной вклад в образование ВЗМО двуокиси углерода, представленной на рисунке 4.4 дают 2 py -орбитали атомов кислорода молекулы. Аналогичный анализ ВЗМО аниона двуокиси углерода (рис. 4.5), по данным UHF PM3, дает следующую структуру волновой функции:
Ψ = 0,0395 2 s (O) + 0,3080 2 px (O) + 0,42392 2 py (O) – 0,40032 2(C) –
– 0,2099 2 px (C) – 0,4935 2 y (C) + 0,039525 2 s (O) + 0,0917 2 px (O) + + 0,5159 2 py (O)
Из данного разложения МО ЛКАО видно, что в формировании ВЗМО аниона двуокиси углерода принимают участия не только кислородные 2py атомные орбитали, но и s -, p -АО центрального атома углерода.
Нетрудно заметить, что в ряду рассмотренных нами молекул (табл. 4.4) двуокиси серы и азота обладают наибольшими значениями СЭ, равными соответственно 2,096 и 1,781 эВ.
С позиции классической физической химии эти эффекты претерпевают довольно простое объяснение, обусловленное более высокими степенями окисления серы и азота в указанных соединениях. Интересно отметить, что при переходе от CO2 к CO, и от NO2 к NO, то есть при изменении степеней окисления углерода и азота с +4 на +2 наблюдаются соответствующие уменьшения величин сродства к электрону данных соединений.
Как уже отмечалось выше, электронный пучок, исходящий из игольчатого катода провоцирует, как мономолекулярные диссоциативные процессы, так и разнообразные бимолекулярные типы химического взаимодействия в водно-газовой смеси в реакционных зонах экспериментальной газоочистной установки. Безусловно, что реакции второго и более порядков, идущие при химическом столкновении электронно-возбужденных молекул с частицами газовой смеси являются более разнообразными и дают наибольший вклад в технологическую цепочку практического выхода конечных продуктов реакции.
Однако для понимания механизмов протекания большинства этих реакций необходимо установить первопричины зарождения реакционных цепей, а именно изучить поведение исходных химических частиц, подвергшихся начальному электронному облучению.
Более детальный анализ физико-химических свойств молекул, их ионизированных производных можно произвести квантово-химическими расчетами и построением потенциальных кривых, иллюстрирующих те или иные каналы диссоциации указанных частиц, то есть их конкретную мономолекулярную реакционную способность.
На рисунке 4.6 приведены подобного рода потенциальные кривые, характеризующие мономолекулярную диссоциацию простейших модельных частиц, в частности, молекулы водорода и ее парамагнитных катиона и аниона.

Рис. 4.6. Потенциальные кривые диссоциации: a — H2; b — H2–; c — H2+
Из рисунка 4.6 видно, что отрыв электрона от молекулы водорода приводит к образованию молекулярного иона водорода, который является более возбужденным или «горячей» химической частицей по сравнению с исходной электронейтральной молекулой. Аналогичный эффект, но в меньшей степени, сопровождает процесс присоединения катодного электрона к молекуле водорода. Необходимо отметить очень важный факт, что процесс ионизации существенно снижает энергию диссоциации образующихся частиц по сравнению с таковой величиной для молекулярного водорода.
В частности, по данным UHF PM3 квантово-химического пакета MOPAC-7, энергия диссоциации молекулы водорода получается равной Ед = 4,9 эВ, в то время как для молекулярного аниона она составляет 2,6 эВ, а для катиона 2,1 эВ. Подобного рода данные позволяют предположить, что электронная ионизация некоторых молекул будет способствовать диссоциации, как, например, молекула водорода на парамагнитные атомы, протоны и гидрид-ионы, уже на начальных стадиях реакционных цепей газоочистной установки.
В настоящей работе были проведены аналогичные квантово-химические расчеты с другими газовыми молекулами, участвующими в электрохимических процессах в экспериментальной установке, эти данные представлены в таблице 4.5.
Из сопоставлений полных энергий исходных молекул и их ионных форм можно заметить, что практически во всех случаях отрыв электрона из молекул или их катионная ионизация приводит к образованию более возбужденных структурных форм по сравнению с исходными молекулами, которые, тем не менее, обладают достаточно глубокими потенциальными ямами с диссоционными пределами, сопоставимыми с энергиями распада материнских электронейтральных частиц.
Таблица 4.5
Полные энергии и энергии диссоциации молекул
и их ионных форм по данным UHF PM3, в эВ
| Название | Молекула | Анион | Катион | |||
| Еп | Ед | Еп | Ед | Еп | Ед | |
| H2 | –31,245 | 4,9 | –27,021 | 2,6 | –15,668 | 2,1 |
| N2 | –324,265 | 11,0 | –324,061 | 10,2 | –310,471 | 10,0 |
| O2 | –583,704 | 9,8 | –584,425 | 5,4 | –572,559 | 6,7 |
| H2O | –324,898 | 4,5 | –321,950 | 0,4 | –312,825 | 5,0 |
| SO2 | –772,356 | 5,3 | –774,473 | 5,1 | –762,598 | 5,4 |
| CO2 | –706,159 | 6,1 | –706,593 | 4,8 | –693,746 | 5,8 |
| CO | –411,421 | 12,3 | –410,674 | 9,8 | –398,568 | 8,3 |
| NO | –453,742 | 7,1 | –454,094 | 6,9 | –444,047 | 8,0 |
| NO2 | –746,444 | 4,1 | –748,225 | 4,7 | –737,326 | 4,6 |
В то же время процессы присоединения катодного электрона к газовым молекулам реакционной зоны вызывают весьма неоднозначные эффекты, выражающиеся не только повышением полной энергии (Еп) образующихся соответствующих анионов, но также в большей термодинамической стабилизации отрицательно заряженных частиц по сравнению с исходными молекулами, как это имеет место для молекул кислорода, двуокиси серы и окислов азота (см. табл. 4.5). Вместе с тем, как и в случае катионов, за исключением молекул водорода и воды, в большинстве своем энергии диссоциации ионных структур являются сопоставимыми по величине с таковыми для исходных молекул.
Как известно, вода занимает особое место в газоочистной установке и ее пары подвергаются ионизации в электродном пространстве. Как следует, из данных таблицы 4.5, взаимодействие молекул воды с катодными электронами приводит к резкому снижению энергии диссоциации, образующейся ионной структуры по сравнению с исходной частицей. Нами были проведены детальные квантово-химические исследования этого феномена с целью выяснения природы данного эффекта.
На рисунке 4.7 представлена графическая зависимость полной энергии молекулярного аниона воды от длины ковалентной OH-связи, подвергающейся разрыву.

Рис. 4.7. Зависимость полной энергии аниона молекулы воды от длины одной из OH-связи
Методом UHF PM3 показано, что при растяжении ОH-связи в анионе молекулы воды до R = 1,2 Å, уже происходит диссоциация последней на ион гидроксила и атом водорода, что отражено на рисунке 4.8, полученным графическим драйвером квантово-химического пакета HYPERCHEM.
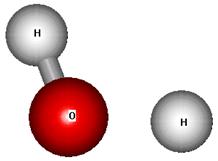
Рис. 4.8. Структура аниона молекулы воды при R = 1,2 Å
Следует отметить, что экстремальные точки, имеющиеся на рисунке 4.7, обусловлены перманентными изменениями валентного угла в анионе молекулы воды, происходящими при растяжении ковалентной ОH-связи. На рисунке 4.9 представлена графическая зависимость аналогичная потенциальной кривой, имеющейся на рисунке 4.7, но с тем отличием, что при квантово-химическом расчете валентный угол в анионе молекулы воды принимался постоянным и равным 104° (рис. 4.9).

Рис. 4.9. Энергетические и зарядовые характеристики диссоциации аниона молекулы воды
Пиктографический анализ точек потенциальной кривой на рисунке 4.9, показывает, что при растяжении ОH-связи в анионе молекулы воды на R = 1,1 Å и более происходит гомолитическое отщепление атома водорода и образование гидроксильного аниона. Данный механизм диссоциации аниона молекулы воды подтверждается изменением зарядов на реперных атомах частицы, из которых видно, что при удалении атома водорода, заряд на нем приближается к нулевой величине, в то время как заряд на анионе гидроксила, как видно по атому кислорода стремится к отрицательной величине q O = –1 (рис. 4.9).
На рисунке 4.10 представлена геометрическая структура и соответствующая ВЗМО интермедиата диссоциации аниона молекулы воды, которая образуется при R = 1,6 Å. Эта структура соответствует второму энергетическому минимому потенциальной кривой, представленной на рисунке 4.9. Рисунок 4.10 констатирует факт гомолитического отрыва атома водорода от молекулы воды при бомбардировке последней катодными электронами газоочистной установки.

Рис. 4.10. Структура и МО интермедиата диссоциации аниона молекулы воды при R = 1,6 Å
Интересно отметить, что аналогичные расчеты аниона молекулы воды, проведенные нами более прецизионными неэмпирическими методами квантовой химии, показывают, что захват молекулами воды свободного (катодного) приводит к моментальному распаду ее на атом водорода и анион гидроксила. Данный факт говорит о том, что основным источником восстановительных процессов в электроразрядной газоочистной установке могут оказаться молекулы воды, которые генерируют атомарный водород электрическим разрядом. Следует подчеркнуть, что и другие ионизированные частицы проявляют характерные им реакционные способности, но в большинстве своем, вступая в реакции второго и более порядков, как индивидуальные горячие частицы, так как они обладают достаточно большими значениями энергий мономолекулярной диссоциации (см. табл. 4.5).
4.4.2. Электроразрядные восстановительные реакции
в комплексах и кластерах диоксида углерода и воды
Многочисленные экспериментальные исследования продуктов реакции, образующихся в газоразрядной установке, показывают, что в сильном электрическом поле игольчатых катодов происходит восстановление диоксида углерода до элементарного состояния с последующей самоорганизацией углеродных атомов в более сложные его модификации фуллеренового типа [196–198, 203].
Специфические условия данной реакционной системы предполагают синхронизованное протекание в ней различных окислительно-восстановительных процессов с участием, как индивидуальных газовых молекул диоксида углерода и воды, их самоассоциатов, так и всевозможных межмолекулярных комплексов, в том числе, и кластерного типа, инициированных элементарными ионизационными стадиями реагентов электрическим полем [204, 205].
Следует отметить, что напряжение в межэлектродном пространстве разрядной установки достаточно как для ионизации молекул и их комплексов с образованием соответствующих катионов, а наличие потока свободных электронов, образующихся при катодной эмиссии, сопровождается их захватом многокомпонентной газовой реакционной фазой с образованием анионных структур [206].
В данной работе основное внимание уделено молекуле двуокиси углерода, электронным свойствам ее ионизированных форм, комплексообразованию диоксида углерода с молекулой воды, само- и гетероассоциации последних, комплексам и кластерам, их строению и реакционной способности. Теоретический анализ указанных вопросов производился с помощью современного пакета квантово-химических программ GAUSSIAN-2003, включающего в себя как полуэмпирические, так и ab-initio методы расчетов электронной структуры [192, 207].
С точки зрения классической химии, межмолекулярный комплекс двуокиси углерода с молекулой воды является нестабильной угольной кислотой, в которой атом углерода ковалентно связан с двумя гидроксильными группами и двойной связью с атомом кислорода. Для решения данного вопроса, конверсии указанного бинарного комплекса в двухосновную кислоту, были проведены неэмпирические исследования механизма такой реакции в базисе 6–31G.
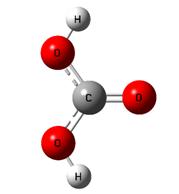
Квантово-химические исследования различных по строению межмолекулярных комплексов двуокиси углерода с молекулой воды показали, что наиболее термодинамически стабильным из всех возможных структур является конфигурация представленная на рисунке 4.11а.
 |  |
| а) | б) |
Рис. 4.11. Расчетные структуры, полученные неэмпирическим методом в базисе 6–31G: а — комплекса диоксида углерода с водой; б — угольной кислоты
Следует отметить, что вышеуказанные теоретические расчеты предсказывают эндотермичность образования угольной кислоты из приведенного межмолекулярного комплекса. Разница в энергии указанных частиц составляет Δ Н = 0,15 ккал/моль. Также следует, что геометрическая структура угольной кислоты, представленная на рисунке 4.11б, является наиболее устойчивой среди трех известных конформеров угольной кислоты. Безусловно, что вопрос динамики протонов по соответствующим водородным мостикам в структуре 4.11а представляет собой предмет отдельных исследований. Из всего сказанного можно резюмировать, что нестабильность угольной кислоты, т.е. отсутствие ее в свободном состоянии в природе, объясняется энергетической предпочтительностью реакционных каналов ее дегидратации, характеризующиеся большей термодинамической устойчивостью соответствующих бинарных комплексов.
Ранее, нами было показано, что в вышеупомянутой электроразрядной установке катодно-электронное облучение молекул воды приводит к предпочтительной генерации атомов водорода, которые будут расходоваться на химическое восстановление сопутствующих окислов любой природы до элементарного состояния, реакционные каналы подобного рода реакций атомарного водорода, в настоящее время, являются подробно изученными [196, 204].
Для анализа химической устойчивости комплексов и кластеров двуокиси углерода и механизмов их диссоциации под воздействием ионизирующего высоковольтного электрического поля и катодно-электронной бомбардировки указанных частиц нами были проведены ab-initio расчеты соответствующих систем (табл. 4.6–4.8).
Таблица 4.6
Теплоты образования самоассоциатов двуокиси углерода
по данным ab-initio расчетов в базисе 6–31G
| Система | Еп, а.е. | Комплекс | Еп, а.е. | Δ Н, ккал/моль |
| 1СО2 | –187,51495 | |||
| 2СО2 | –375,02990 | Димер | –375,03273 | –1,78 |
| 3СО2 | –562,54485 | Тример | –562,55425 | –5,89 |
| 4СО2 | –750,05981 | Тетрамер | –750,07429 | –9,08 |
Таблица 4.7
Теплоты образования анионов самоассоциатов двуокиси углерода по данным ab-initio расчетов в базисе 6–31G
| Комплекс | Еп, а.е. | Анион | Еп, а.е. | Δ E, ккал/моль |
| СО2 | –187,51495 | СО2– | –187,40784 | 67,16 |
| Димер | –375,03273 | Димер-анион | –375,00074 | 20,06 |
| Тример | –562,55425 | Тример-анион | –562,53933 | 9,35 |
| Тетрамер | –750,07429 | Тетрамер-анион | –750,08155 | 4,55 |
Таблица 4.8
Теплоты образования катионов самоассоциатов двуокиси углерода по данным ab-initio расчетов в базисе 6–31G
| Комплекс | Еп, а.е. | Катион | Еп, а.е. | Δ E, ккал/моль |
| СО2 | –187,51495 | СО2+ | –187,06536 | 374,58 |
| Димер | –375,03273 | Димер-катион | –374,60336 | 269,25 |
| Тример | –562,55425 | Тример-катион | –562,13042 | 265,77 |
| Тетрамер | –750,07429 | Тетрамер-катион | –749,66355 | 258,19 |
Как видно из расчетных данных, представленных в таблицах 4.6–4.8, отрыв электрона от диоксида углерода в большей степени возбуждает ее по сравнению с процессом поглощения этой молекулой одного электрона катодной пушки. С этой точки зрения представлялось интересным установление предельной зарядной емкости мономерной молекулы углекислого газа, граничащей с последующей диссоциацией диоксида на атомарный углерод.
В рамках используемого квантово-химического метода нами было обнаружено, что отщепление атома углерода от диоксида будет иметь место при присоединении последним трех катодных электронов или при потере им трех собственных электронов под воздействием высоковольтного электрического поля (рис. 4.12, 4.13).
 | (а) |
 | (b) |
Рис. 4.12. Структуры и ВЗМО трехзарядного аниона диоксида углерода: а — в дублетном спиновом состоянии; b — в квартетном спиновом состоянии
 | (а) |
 | (b) |
Рис. 4.13. Структуры и ВЗМО трехзарядного катиона диоксида углерода: а — в дублетном спиновом состоянии; b — в квартетном спиновом состоянии
Следует подчеркнуть, что при распаде анионной формы диоксида, атом углерода образуется как из дублетного, так и квартетного спиновых состояний этой частицы. Трехзарядный же катион углекислого газа генерирует атом углерода только из квартетного спинового состояния, в то время как аналогичный распад дублетного терма возможен только при удалении пяти электронов из электронной оболочки трехатомной молекулы.
Из данных таблицы 4.6 следует, что самоассоциаты диоксида углерода обладают существенной термодинамической стабильностью, которая возрастает по мере перехода от димера к тетрамеру. На рисунке 4.14 представлены расчеты геометрических структур, полученных при полной оптимизации их неэмпирическим методом в базисе 6–31G.
 |  |  |
| a | b | c |
Рис. 4.14. Строение самоассоциатов диоксида углерода: a — димера; b — тримера; c — тетрамера
Расчетные данные позволяют предположить, что диоксид углерода может образовывать самоассоциаты и более сложного строения кластерного типа. Однако, в данной работе мы ограничились, в силу известных квантово-химических обстоятельств, рассмотрением относительно небольших структур, которые позволяют вместе с тем уловить существующие закономерности в структурах подобного рода.
Из данных, приведенных в таблицах 4.7, 4.8 видно, что эндотермические процессы ионизации диоксида углерода и его ассоциатов имеют тенденцию к понижению этого термодинамического эффекта по мере роста геометрической конфигурации комплекса. Видно также, что однозарядные катионы ассоциатов углекислого газа обладают существенно меньшей термодинамической стабильностью, чем соответствующие анионы.
Также было обнаружено, что по мере увеличения количественного состава самоассоциатов диоксида углерода, т.е при переходе от вышеприведенных мономера к тетрамеру (табл. 4.6, рис. 4.14), уменьшается число катодных электронов необходимых для соответствующего диссоциативного процесса в комплексах с выделением элементарного атома водорода. Например, если для подобного распада диоксида углерода требуется три электрона, то для димера — 5, тримера — 7, а для тетрамера — 9.
Другими словами, удельное количество электронов, требующихся для восстановления одной мономерной молекулы углекислого газа в этих образованиях уменьшается. Данное явление можно резюмировать также, что комплексы и кластеры диоксида углерода более подвержены к образованию элементарного углерода в условиях электроразрядной установки, чем мономерная молекула. С химической точки зрения это означает более высокую реакционную способность кластерных образований.
Поскольку роль анода в электроразрядной установке выполняет вода, нами были проведены аналогичные квантово-химические расчеты для паров воды и ее самоассоциатов с использованием ab-initio расчетов и базиса 6–31G.
Таблица 4.9
Теплоты образования самоассоциатов воды
по данным ab-initio расчетов в базисе 6–31G
| Комплекс | Еп, а.е. | Комплекс | Еп, а.е. | Δ Н, ккал/моль |
| 1H2O | –75,98535 | |||
| 2H2O | –151,97071 | Димер | –151,98321 | –7,83 |
| 3H2O | –227,95607 | Тример | –227,99485 | –24,3 |
| 4H2O | –303,94143 | Тетрамер | –304,00898 | –42,35 |
Как следует из данных таблицы 4.9, самоассоциация молекул воды в димеры, тримеры и тетрамеры, также как и в случае с диоксидом углерода, является термодинамически выгодным процессом. Причем теплоты образования комплексов, в обоих случаях растут со степенью ассоциации молекул.
В отличие от диоксида углерода, оксид водорода или вода претерпевает гомолитическую диссоциацию с отщеплением атома водорода уже при присоединении одного катодного электрона. Причем, такое одноэлектронное расщепление имеет место, как в мономерной молекуле воды, так и в его димере, и тримере. Для аналогичного распада тетрамера воды, согласно расчетным данным, уже требуется диссоциативное присоединение к комплексу второго катодного электрона.
Полученные таким образом квантово-химические результаты полностью подтверждают сделанные нами ранее предположения, что катодное расщепление молекул воды в рассматриваемом реакторе являются главным источником атомарного водорода, восстанавливающего примесные окислы различных элементов до свободного химического состояния [208, 209].
Необходимо подчеркнуть, что удаление одного электрона из молекулы воды не сопровождается диссоциативным процессом, так как образующийся при этом катион радикал является термодинамически устойчивой структурой. Естественно, что валентный угол у такой частицы будет больше, чем в нейтральной молекуле воды и составит 119° (рис. 4.15а).
 |  |
| a) | b) |
Рис. 4.15. Продукты одноэлектронного окисления молекулы воды и ее димера в зоне реактора: а — катион-радикал воды; b — гидроксильный радикал и катион гидроксония
Аналогичная ионизация димера воды приводит к образованию гидроксильного радикала (см. рис. 4.15b), реакционная способность которого в окислительно-восстановительных процессах общеизвестна [209]. Такому же распаду при одноэлектронном окислении в зоне реактора с образованием гидроксильного радикала подвергаются тример и тетрамер молекулы воды. Квантово-химическое исследование более сложных кластеров воды, как видно из приведенных данных, не представляет интереса с позиции теоретической химии в рассматриваемом аспекте.
Совершенно естественным, на основании полученных результатов, было проведение аналогичного квантово-химического анализа поведения в зоне рассматриваемого реактора гетеромолекулярных комплексов, в частности, диоксида углерода и оксида водорода (воды). Выше мы показывали предполагаемую динамику конверсии межмолекулярного комплекса углекислого газа с молекулой воды в угольную кислоту.
В таблице 4.10 приведены термодинамические данные, характеризующие поведения комплексов диоксида углерода с различным количеством молекул воды при присоединении ими одного катодного электрона газоразрядного реактора.
Таблица 4.10
Теплоты образования анионных комплексов диоксида углерода
с молекулой воды, по данным ab-initio расчетов в базисе 6–31G
| Комплекс | Еп, а.е. | Анион | Еп, а.е. | Δ Е, ккал/моль |
| СО2+Н2О | –263,50977 | (СО2+Н2О)– | –263,49873 | 6,92 |
| СО2+2Н2О | –339,50092 | (СО2+2Н2О)– | –339,51069 | –6,12 |
| СО2+3Н2О | –415,52145 | (СО2+3Н2О)– | –415,50976 | 7,33 |
| СО2+4Н2О | –491,53313 | (СО2+4Н2О)– | –491,41128 | 76,41 |
Следует отметить, что по расчетным данным, все образующиеся при этом анион-радикальные частицы являются термодинамически устойчивыми структурами и не подвергаются вынужденной диссоциации. Вместе с тем, из числа приведенных комплексов, видно, что продукт взаимодействия диоксида углерода с двумя молекулами воды стоит особняком, проявляя наибольшую термодинамическую устойчивость соответствующего ему аниона, экзотермическое образование которого составляет
Δ Е = –6,12 ккал/моль. Из таблицы 4.10 видно, что для остальных аналогичных трех комплексов процесс присоединения электрона является эндотермическим.
Пиктографический анализ, проведенный с помощью графического драйвера GAUSSVIEW квантово-химического пакета GAUSSIAN-2003, показал, что эффект экзотермичности ионизации билигандного комплекса диоксида углерода обусловлен специфической геометрией данного образования, в котором две молекулы воды связаны с молекулой комплексообразователя двумя прочными водородными мостиками ОНО (рис. 4.16а).
Из рисунка 4.16b видно, что координация трех молекул воды с молекулой углекислого газа может осуществляться присоединением водного тримера только лишь по одному реакционному центру комплексообразователя.
 |  |
| а) | b) |
Рис. 4.16. Геометрические структуры анионных комплексов диоксида углерода с молекулой воды: а — билигандного; b — трилигандного
Возвращаясь к катионным структурам комплексов диоксида углерода с одной — четырьмя молекулами воды, по данным использованных в работе квантово-химических расчетов, следует подчеркнуть, что все эти структуры в той или иной мере подвергаются диссоциации с отщеплением атомов водорода и гидроксильного радикала.
Дальнейшие построения и квантово-химические исследования были проведены нами с кластерными образованиями типа 2СО2–Н2О, 2СО2–2Н2О, 2СО2–3Н2О, 2СО2–4Н2О (рис. 4.17 и 4.18).
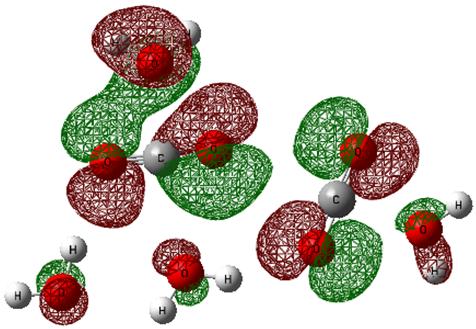
Рис. 4.17. Геометрическая структура и ВЗМО кластера, образованного из двух молекул диоксида углерода и четырех молекул воды

Рис. 4.18. Геометрическая структура и ВЗМО однозарядного анионного кластера, образованного из двух молекул диоксида углерода и двух молекул воды
Из проведенных квантово-химических расчетов вышеуказанных молекулярных систем следует, что их модельные кластеры не разрушаются при захвате или потере одного электрона в реакционной зоне.
Как видно из соответствующих данных, представленных в таблице 4.11, присоединение одного катодного электрона перечисленными кластерами не оказывает заметного влияния на термодинамическую стабильность последних.
Причем, анионная форма комплекса 2СО2–2Н2О является термодинамически более устойчивой чем исходная нейтральная частица.
Таблица 4.11
Термодинамические параметры комплекса двуокиси углерода
и их однозарядно ионизированных форм
| Комплекс | 2СО2+Н2О | 2СО2+2Н2О | 2СО2+3Н2О | 2СО2+4Н2О |
| Еп, а.е. | –451,03358 | –527,02804 | –603,02879 | –679,02098 |
| Анион | 2СО2+Н2О– | 2СО2+2Н2О– | 2СО2+3Н2О– | 2СО2+4Н2О– |
| Еп, а.е. | –451,03117 | –527,03559 | –603,02232 | –679,01078 |
| Δ Е, ккал/моль | 1,64 | –4,73 | 4,05 | 6,39 |
| Катион | 2СО2+Н2О+ | 2СО2+2Н2О+ | 2СО2+3Н2О+ | 2СО2+4Н2О+ |
| Еп, а.е. | –450,64205 | –526,63719 | –602,58763 | –678,58852 |
| Δ Е, ккал/моль | 245,52 | 245,09 | 276,64 | 271,19 |
Катионные структуры указанных комплексов являются существенно менее устойчивыми, чем соответствующие исходные образования (см. табл. 4.11). Интересная внутрикластерная химия в соединениях, представленных в таблице 4.9, начинается при их двукратной ионизации.
На рисунке 4.19 показано, что присоединение двух электронов комплексом 2СО2–2Н2О приводит к ковалентному связыванию двух молекул диоксида углерода с образованием парамагнитного пероксида и свободного гидроксильного радикала. Аналогичный эффект имеет место и при потере двух электронов рассматриваемым комплексом.

Рис. 4.19. Геометрическая структура и ВЗМО двухзарядного анионного комплекса 2СО2–2Н2О

Рис. 4.20. Пространственная структура молекулы фуллерена С60
Безусловно, все эти образующиеся интермедиаты являются химически высоко реакционноспособными и могут приводить к самоорганизации в реакционной зоне таких стабильных упорядоченных структур как фуллерены и их производные (рис. 4.20) [192, 203, 210–215].
Уникальное строение данной структурной модификации углерода характеризуется высокой термодинамической стабильностью. В частности, нами было обнаружено, что молекула фуллерена С60 может поглотить до 35 электронов, в том числе и катодных, не подвергаясь при этом диссоциативным процессам.
 2017-12-14
2017-12-14 1437
1437








