Диссоциация оксидов углерода в газовых разрядах изучалась в самых разнообразных разрядных процессах в газовых системах — тлеющем, ВЧ-, СВЧ-, плазменно-пучковом, дуговом разрядах, в разряде с полым катодом, при плазменном радиолизе, в несамостоятельных разрядах, поддерживаемых электронными пучками, УФ-излучением и др. [102, 174–176].
Однако, разнообразие условий в различных формах электрических разрядов, включающих и низкотемпературный тлеющий разряды при низком давлении, и сверхмощный импульсный разряд, температуры в котором достигают миллиона градусов, не позволяет говорить о какой-то единой и всеобъемлющей теории химических реакций в электрических разрядах. Можно отметить некоторые положения, по которым развивается теоретическое изучение реакций в разрядах.
Источником энергии в разряде является электрическое поле, сообщающее ускорение в первую очередь подвижным электронам, которые передают свою энергию молекулам газа посредством упругих и неупругих ударов. При последних совершаются акты возбуждения и ионизации молекул, а также их диссоциации на свободные радикалы или атомы [4, 13–15].
Принципиально, любая из этих частиц, т.е. возбужденная молекула, ион и свободный радикал, может являться химически активной частицей, участвующей в первичном элементарном акте. За первичным актом могут последовать, в зависимости от условий, различные вторичные реакции, причем, последние могут развиваться не только в самой плазме разряда, но и где-то около нее и на стенках разрядной трубки. Таким образом, весьма сложная задача изучения механизма реакции в разряде состоит, во-первых, в установлении природы первично активной химической частицы и характера первичного элементарного акта, а во-вторых, в изучении возможных вторичных реакций.
4.2. Механизмы химических превращений газовых компонентов в активной зоне электрического поля
высокой напряженности
Технологические газы, поступающие для очистки в установку, имеют следующий компонентный состав: СО2, СО, SO2, СН4, N2, О2, Н2О. В соответствии с литературными данными [13–15, 177–179] в реакционной зоне осуществимы реакции полной или частичной диссоциации всех компонентов с образованием элементарных веществ и различных соединений. Основными продуктами реакции являются (для газовой смеси с оксидами углерода): вода, кислород и сажа.
Рассмотрим возможные механизмы химических превращений компонентов газовой смеси в активной зоне электрического поля высокой напряженности.
1) Образование свободных радикалов и молекулярных продуктов в парах воды Н2О. При прохождении через газ импульса электрического тока (электрического разряда) в газе образуются ионы и высоковозбужденные состояния молекул. Распад возбужденных молекул и рекомбинация ионов приводят к образованию свободных радикалов. При разряде в воздухе в присутствии паров воды происходит распад возбужденных молекул воды с образованием свободных радикалов:
Н2О → Н · + О · (4.1)
Взаимодействие первичных радикалов может привести к образованию вторичных радикалов НО2 · и молекулярных продуктов О3, Н2О2 [177–179]. Наибольший вклад в химические процессы вносят реакции Н, О, ОН и НО2.
Из-за протекания быстрой реакции О + ОН → О2 + Н количество атомов О и радикалов в продуктах разряда в парах воды может быть незначительным. При отсутствии в газовой фазе над поверхностью воды кислорода и соответственно озона радикалы ОН · иН ·, образующиеся при развале молекулы воды, мгновенно рекомбинируют и не участвуют в других реакциях. Радикалы ОН · и НО2 · в присутствии озона превращаются один в другой: ОН · ↔ НО2 ·. Образование радикалов НО2 · в разряде происходит по реакции:
ОН + Н2О2 → ОН2 + Н2О (4.2)
Следует также отметить, что если плотность ионизации в разряде слишком велика, то образующиеся первичные радикалы будут взаимодействовать в первую очередь между собой [178].
В парах воды впрыснутые электроны становятся гидратированными и они могут превращать радикалы ОН · в неактивные ионы ОН -, а остающиеся атомы водорода будут участвовать в восстановительных процессах в газовой среде.
Другим возможным механизмом является распад молекул воды на ионы:
Н2О → Н + + ОН – (4.3)
е → е aq
Гидратированный электрон превращает ион водорода в атом (радикал) в присутствии третьей частицы:
е aq + Н + + М → Н · + М
Ионы ОН– остаются без изменения, заряд среды определяется числом впрыснутых электронов. В результате среда становится сильно восстановительной.
Результаты подробных измерений методом ЭПР концентраций атомов, радикалов и свободных электронов на выходе из ВЧ- и СВЧ-разрядов в смесях Н2 + О2, Н2О, О2+Н2О, а также в Н2, Аr+H2, O2, Ar+O2 приведены в [179]. Степень диссоциации воды в разряде может составлять 50–100 %. При малых значениях постоянного тока плазмы тлеющего разряда степень диссоциации Н2О невелика, однако при увеличении тока происходит почти полная диссоциация [180].
2) Электрохимические превращения оксидов углерода в газоразрядной зоне.
а) Электрические разряды в диоксиде углерода. Имеющиеся в литературе данные по механизму электрохимического превращения оксидов углерода в активных зонах электрического разряда, в основном, описывают процесс полной или частичной диссоциации. Наиболее подробно этот процесс исследован в Растворах в цикле работ, проведенных в ИНХС АН СССР [67, 102] в условиях тлеющего разряда в углекислом газе при давлении 1–4 атм, плотности тока 1–10 мА/см2 и Е/N0 6–9 . 10–6 В∙см–2. Основными продуктами разряда в СО2 являются О2, СО и СО2. В зоне разряда в значительных концентрациях присутствуют атомы О, при этом О/О2 = 0,1.
Авторы работ [174] проводили исследования диссоциации двуокиси углерода в тихом электрическом разряде (в озонаторе). Анализ продуктов диссоциации проводили вне зоны разряда методами масс-спектроскопии, газовой хроматографии и по перепаду давлений. На основании спектроскопических исследований было установлено, что основными продуктами в данных условиях являются СО2, СО, О2 и О3.
Диссоциация СО2, О2 и СО происходит при столкновениях с электронами в результате возбуждения нестабильных и предиссоциирующих электронных состояний, а также при столкновениях с электронно-возбужденной метастабильной молекулой СО(а3П). В реакции СО + СО(а3П) → СО2 + С образуются
«горячие» (обладающие избыточной поступательной энергией) атомы углерода. Атомы углерода очень реакционноспособны, важным процессом гибели горячих атомов С является реакция
СО2 + С → 2СО.
В импульсном СВЧ-разряде высокой мощности (30 кВ время импульса 0,3 мкс, частота импульса 500 Гц), в условиях электронного циклотронного резонанса при давлении 50 мм рт. ст. происходит диссоциация углекислого газа до элементарного углерода [174, 175].
б) Электрические разряды СО2 в присутствии паров воды. При добавлении паров воды в исходный СО2 в разряде образуются радикалы ОН ·, которые вступают в быстрые реакции
ОН + О → О2 + Н и ОН + СО → СО2 + Н, приводящие к образованию О2 и СО2.
Были рассмотрены процессы, протекающие в озонаторе с учетом диффузии (случай идеального вытеснения), и выведено уравнение, связывающее изменение концентрации во времени пребывания газа в зоне разряда:
 , (4.4)
, (4.4)
где С — концентрация СО в объёме разрядной зоны; Cu — концентрация СО в искре; n — количество искр на всей длине разрядной зоны; Su — площадь отдельной искры; β — скорость диффузии частиц из искры в окружающее пространство;  o — объём разрядной зоны озонатора;
o — объём разрядной зоны озонатора;  — время пребывания в элементе di.
— время пребывания в элементе di.
Уравнение приближенно описывает процесс образования молекул СО в разрядной зоне.
в) Электрические разряды СО2 в смеси с водородом. В лаборатории газовой электрохимии МГУ выполнен цикл исследований, посвященных восстановлению углекислого газа в тлеющем электрическом разряде [176]. При этом стабильными продуктами разряда в смеси СО2 и Н2 являются СО и Н2О и, в некоторых случаях углерод. А под действием импульсного искрового разряда примесь СО2 в водороде превращается в метан СН4. Предполагают [176–179], что под действием импульса происходит диссоциация СО2 до атомарного углерода, а при столкновении его с избытком Н2 образуется метан СН4. При высоком содержании водорода (до 90 %), среди продуктов, масс-спектроскопически обнаружены малые количества этилена, ацетилена, при меньшем содержании водорода (25 %) в продуктах обнаруживаются спирты, альдегиды и кислоты.
г) Электрические разряды СО в смеси с водородом. Возможность восстановления окиси углерода описывает Мак-Таггарт [93] в микроволновом разряде в среде с достаточным содержанием атомов водорода. В качестве главного продукта был найден формальдегид, полимеризационное вещество с эмпирической формулой С25Н35О и некоторое количество аморфного углерода С.
В статических и циркулирующих системах при давлении 10–50 мм рт. ст. и времени реакции несколько минут получено значительное количество СН4 и С2Н2 и паров воды. Выход углеводородных газов (в основном СН4) на основе СО достигал до 78 % при непрерывном вымораживании водяного пара в системе [93]. В работах [67, 68] выдвигается гипотеза о том, важную роль в химических превращениях в плазме СО + Н2 играют реакции колебательно возбужденных молекул Н2, например СО + Н2(v) → → Н2СО.
При пропускании смеси СО + Н2 через СВЧ-разряд, при давлении 10–100 мм рт. ст., образовывались СН4 и ацетилен С2Н2; наибольшие выходы этих веществ составили 7 и 5 % соответственно.
С помощью метода ЭПР в газовой фазе можно зарегистрировать концентрации только ограниченного числа парамагнитных частиц. Для получения более полной информации о газофазных концентрациях частиц и о характере химических процессов, протекающих в соединительном канале, было проведено математическое моделирование процессов.
Таким образом, из всего вышеизложенного и с учетом экспериментальных данных следует, что в прикатодной униполярно заряженной области установки, в условиях неравновесной слабоионизированной плазмы, осуществимо протекание ионизационных и диссоциативных процессов с образованием различных радикалов и ионов [180].
В совокупности все эти процессы приводят к восстановлению оксидов углерода:
а) протекание полной или частичной диссоциации оксидов углерода:
СО2→ С + О2 (4.5)
СО2→ СО + ½ О2 (4.6)
СО→ С + ½ О2 (4.7)
СО* + СО* ↔ С +СО2 (4.8)
СО2*(г) + С(т) → С(о) + СО(г) (4.9)
б) процессы восстановления атомарным водородом:
СО2 + Н → С + Н2О (4.10)
СО + 2Н → С + Н2О (4.11)
в) взаимодействие оксидов углерода с атомарным кислородом:
СО2* + О → СО + О2 (4.12)
г) взаимодействие оксидов углерода c образованием метана, других углеводородов и элементарного углерода:
8Н + СО2 → СН4 + 2Н2О (4.13)
СО + 3Н2↔ СН4 + Н2О (4.14)
СН4 → С2Н2, С2Н4, С2Н3 и др. → твердые продукты (4.15)
Таким образом, в униполярно (отрицательно) заряженной зоне возможны диссоциация диоксида углерода и реакции восстановления.
3) Электрохимические превращения оксидов азота NxOy и сернистого ангидрида SO2 в зоне темнового электрического разряда
Элементный состав оксидов азота совпадает с составом чистого воздуха. В связи с этим, наиболее экономичной системой газоочистки может являться такая, в которой реализуется преобразование оксидов азота непосредственно в молекулярные кислород и азот. Экспериментальному исследованию возможности такого преобразования в смеси, моделирующей дымовой газ, посвящена работа [180, 181]. Опыты проводились на установке, содержащей ускоритель электронов, плазмохимическую камеру и систему контроля, подготовки и напуска исследуемой газовой смеси.
В плазмохимической камере исследуемая смесь принудительно прокачивалась по замкнутому контуру в течение всего времени эксперимента. Во время прокачки смеси без ее облучения электронным пучком в присутствии кислорода в ней происходили процессы естественного химического окисления NO до NO2. Спустя некоторое время в смеси устанавливалось динамическое равновесие между концентрациями оксидов азота, после чего газовая смесь облучалась электронным пучком. Облучение проводилось сериями из 50 импульсов.
Уменьшение концентрации оксидов азота в соответствии с представлениями о свободно-радикальном механизме окисления NO x [181] должно сопровождаться образованием азотной кислоты, как конечного продукта процесса. В описываемых экспериментах кислота была обнаружена в очень малых, практически следовых, количествах. Полученные результаты свидетельствуют о том, что механизмы удаления оксидов азота не исчерпываются только процессами окисления.
Альтернативой свободно-радикальному механизму удаления оксидов азота с образованием в качестве конечного продукта азотной кислоты может являться процесс диссоциации NO х, который приводит к образованию атомов, а затем и молекул, азота и кислорода. Известно, что при инжекции электронов в азотно-кислородную смесь, энергия пучка расходуется не только на ионизацию и возбуждение компонентов смеси, но и на диссоциацию азота [180–183].
Расчет распределения энергии электронного пучка в воздухе, выполненный по методу Монте-Карло, показывает, что на диссоциацию молекул азота прямым электронным ударом расходуется около 2,5 % энергии пучка. Оценки показывают, что в условиях экспериментов концентрация атомарного азота, образовавшегося за счет диссоциации молекул N2 прямым ударом быстрых электронов пучка, не превышает 1012 cм–3. Концентрация атомарного азота в смеси может существенно увеличиваться за счет процессов диссоциативной рекомбинации ионов N+2. Диссоциативная рекомбинация ионов N+ приводит к образованию атомарного азота с концентрацией ~ 8·1013 cм−3 [180, 183].
В дальнейшем протекают реакции с участием атомарного азота и молекул примеси, приводящие к снижению концентрации оксидов азота:
N + NO → N2 + O (4.16)
N + NO2 → 2NO (4.17)
N + NO2 → N2 + 2O (4.18)
О + NO2 → O2 + NO (4.19)
N2O → 2N2 + O2 (4.20)
2NO2 → N2 + 2O2 (4.21)
Атомарные кислород и азот образуют соответствующие молекулы. Таким образом, в работах [180–183] показано, что процессы очистки дымовых газов от оксидов азота импульсными электронными пучками, связаны, в основном, не с окислением, а с диссоциацией NOх, которая особенно эффективно протекает в смесях с малым содержанием кислорода.
Подводя итоги данных литературного обзора, расчетных и экспериментальных результатов изучения характера физико-химических процессов в активной газоразрядной зоне, можно предложить, что в реакциях диссоциативной рекомбинации нарабатывается достаточно высокая концентрация атомарного азота. При взаимодействии последнего с оксидами азота происходит их диссоциация с образованием в качестве конечного продукта молекулярных кислорода и азота. Такой механизм удаления оксидов азота больше всего находится в согласии с теми процессами, которые протекают в активной зоне темнового разряда с участием молекул воды.
Необходимость решения задач защиты окружающей среды, в частности, очистка отходящих газов от диоксида серы, стимулировали в последние годы исследования гетерогенных эффектов при электрическом разряде в газовой фазе. В работах [121, 133] авторами исследовались процессы влияния электрического поля на следующие стадии превращений SO2: окисление сернистого ангидрида, адсорбцию ионизированного газа электрозаряженным водяным паром, биполярную электризацию и коагуляцию тумана серной кислоты, образованной в результате конденсации паров Н2SO4, адсорбцию серного ангидрида серной кислотой. Отмечено, что использование электрических полей активизирует процессы массообмена и адсорбцию, в итоге позволяет получать серную кислоту до 98,3 % чистоты и 15–20 % олеум, а также улавливает сернокислотный туман.
В работах [184, 185] рассмотрены вопросы интенсификации степени окисления сернистого ангидрида кислородом воздуха в условиях барьерного электрического разряда. Барьерный электрический разряд возникает между двумя электрическими барьерами, когда электрическое напряжение, приложенное к слою газа, заключенному между электрическими барьерами, превысит диэлектрическую прочность газового промежутка. Подведенная энергия вызывает изменение: в кислороде, азоте, сернистом ангидриде и других, содержащихся в газовой смеси соединениях. При этом в значительных количествах образуется озон и другие активные формы кислорода (О3, О · 2, О−, О2−, О+ и др.) [185], которые взаимодействуют с активированными молекулами SO2 с образованием SO3.
Измерение концентрации SO2 до и после барьерного разряда показали, что в среднем около 50 % SO2 окисляется в SO3.
Аналогичный процесс электроактивации газов, содержащих SO2 и SO3 проводился в коронирующем электрическом разряде, создаваемом игольчатыми электродами [186]. При подаче высокого напряжения на коронирующие электроды возникает коронный разряд и создается область высокой ионизации. В поле коронного разряда происходит доокисление содержащего в газовом потоке SO2 до SO3 и ионизация газа. Видимо, в коронном разряде в большей степени протекают ион-радикальные реакции. Высокая эффективность очистки газов от SO2 до SO3 получена при токе разряда 8 мА.
Эффективность улавливания сернистого ангидрида в газах составила 72,5 % при начальной концентрации последней 33961 мг/м3, а серного ангидрида — 84,2 % при начальной концентрации SO3 681,37 мг/м3 и 93 % при начальной концентрации SO3 4652 мг/м3 [187, 188].
Рассмотрены также методы электризации, электроактивации и электрокоагуляции промышленных выбросов, в частности, вопросы электризации пыли и тумана, их биполярной зарядки, которая осуществлялась в поле комбинированного коронного разряда [189]. Аэрозольные частицы, попадая в поле коронного разряда, приобретают заряд разной полярности. В этом устройстве происходит биполярная электризация и коагуляция тумана серной кислоты, образованного в результате конденсации паров Н2SO4. Как показали исследования, большое значение при этом имеет межэлектродное расстояние.
Критическое напряжение для положительной и отрицательной короны в устройстве составило 7–9 кВ. При этом частицы приобретают заряд близкий расчетному максимальному заряду и равный 1,6·10–16 Кл. Однако сила тока комбинированного коронного разряда (для отрицательной и положительной короны) гораздо меньше силы тока униполярного отрицательного или положительного коронного разрядов, при одной и той же величине приложенного напряжения U (кВ). Следовательно, заряд, который приобретает частица в комбинированном коронном разряде ниже заряда частицы в поле униполярной короны.
О существовании SO в электрическом разряде в парах SO2 сообщается в работе [93]. Обнаружив наличие свободной серы, отложенной вблизи разряда, авторы предположили возможность последующей диссоциации SO.
Очевидно, если бинарное соединение удается атомизировать в плазменном инертном теплоносителе или в зоне разряда и если один из элементов соединения слаболетуч и легко конденсируется, можно в принципе подобрать такой режим охлаждения (закалки), при котором конденсируется этот элемент и предотвращаются обратные гомо- и гетерофазные реакции.
Результаты исследования электрохимического восстановления молекул сернистого ангидрида SO2, в униполярно (отрицательно) ионизированной области, активными факторами темнового разряда на пилотной установке В4 с получением элементарной серы приведены нами в [158].
Разработанная технология успешно апробирована на Балхашском горно-металлургическом комбинате. Установлено, что очистка технологических дымовых газов осуществляется от аэрозольных примесей до 98–99 % и сернистого ангидрида до 95–98 %.
На основании полученных экспериментальных данных нами предложены следующие возможные механизмы электрохимических превращений, приводящих к восстановлению молекул сернистого ангидрида до элементарной серы в зоне темнового разряда в системе твердый игольчатый электрод–газ–«жидкий» анод:
а) полной или частичной диссоциации молекул диоксида серы
SO2 → S ↓ + O2 (4.22)
б) восстановление сернистого ангидрида атомарным водородом
SO2 + 4H ˙ = S↓ + 2H2O (4.23)
в) восстановление сероводородом с образованием элементарной серы (сероводород является одним из промежуточных продуктов, образующихся при восстановлении сернистого ангидрида):
6H ˙ + SO2 = H2S + 2H2O (4.24)
SO2 + 2H2S = 3S↓ + 2H2O (4.25)
г) в восстановительной газоразрядной среде также возможна реакция диссоциации сероводорода H2S до свободной серы:
Н2S → S + Н2 (4.26)
4.3. Оценка кинетических условий протекания
реакций электрохимического восстановления
оксидов углерода в газоразрядной зоне
Полученные выше результаты не позволяют построить адекватную модель кинетики процессов в рабочей зоне установки В5, однако, на их основе можно получить оценки, необходимые для построения такой модели.
Геометрически рабочая зона представляет собой полость между двумя коаксиальными конусами (рис. 4.1) из которых: внутренний — катод, внешний — анод. Поток очищенного газа вместе с атмосферным воздухом поступает сверху в рабочую область через кольцевую щель между конусами и выходит снизу. Сечение рабочей области конусом, перпендикулярным (как поверхность) конусам анода и катода имеет площадь:
 (4.27)
(4.27)
 (4.28)
(4.28)
 (4.29)
(4.29)
параметры  показаны на рисунке 4.1.
показаны на рисунке 4.1.

Рис. 4.1. Геометрия рабочей зоны: Z — рабочее расстояние между поверхностями анода и катода; α — половина угла у вершины конусов; R 1 — радиус кромки перелива анода; x — расстояние от кромки перелива до текущей точки на аноде вдоль образующей конуса анода; L — длина образующей рабочей части конуса анода; H — высота инжектора
Далее буквой с о обозначены допущения, сделанные в ходе оценок. ао — будем считать, что скорость движения газа не велика и будем оперировать средними значениями скорости потока в рабочей области.
Если Q — расход газа на входе установки и б о — расход не меняется на протяжении всего пути потока одинакового сечения, то:
 — (4.30)
— (4.30)
время, необходимое частице газа для достижения уровня  . В частности:
. В частности:
 — (4.31)
— (4.31)
время пребывания частицы газа в рабочей области,
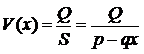 — (4.32)
— (4.32)
средняя скорость движения газа в рабочей области на уровне  .
.
Для установки В5 и условий проведения наших экспериментов:
 = 1,65 м;
= 1,65 м;
 = 1 м;
= 1 м;
 = 0,22 м;
= 0,22 м;
 = 30°.
= 30°.
получим:
 ;
;
 ;
;
 ;
;
 .
.
Для  = 900÷13500 м3/ч = 0,25÷3,75 м3/с; получим данные, приведенные в таблице 4.1.
= 900÷13500 м3/ч = 0,25÷3,75 м3/с; получим данные, приведенные в таблице 4.1.
Таблица 4.1
Параметры газового потока в установке В5
| Q, м3/с | Q = 0,25 м3/с | Q = 3,75 м3/с | ||
| x, | x = 0 | x = L | x = 0 | x = L |
| t, с | 8,08 | 0,54 | ||
| V, м/с | 0,116 | 0,185 | 1,74 | 2,78 |
| S, м2 | 2,149 | 1,351 | – | – |
Объем рабочей области  до уровня
до уровня  :
:
 (4.33)
(4.33)
В частности, объем всей рабочей области:
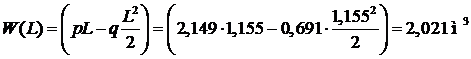 .(4.34)
.(4.34)
При рабочем напряжении Е = 105 кВ ток инжектора по данным опытов и исходя из [158]: I = 3,5·10–3 А, что составляет
 (4.35)
(4.35)
количество ионов, образующихся в секунду на поверхности катода (здесь  — заряд электрона). По расчетным данным плотность ионов, одновременно находящихся в рабочей области составляет
— заряд электрона). По расчетным данным плотность ионов, одновременно находящихся в рабочей области составляет  = 1015 м–3, то есть количество ионов, одновременно находящихся в рабочей области, составляет
= 1015 м–3, то есть количество ионов, одновременно находящихся в рабочей области, составляет
 (4.36)
(4.36)
Таким образом, за время нахождения частицы газа в рабочей области от 0,54 до 8,08 с заряд рабочей области пополнится от

до
 штук,
штук,
то есть полный заряд рабочей области обновится от

до
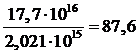 раз
раз
при расходе от 3,75 до 0,25 м3/с соответственно. Количество элементарных зарядов, вышедших из катода на единицу объема прошедшего газа составит:
 (4.37)
(4.37)
и для Q = 0,25÷3,75 м3/с;
 ;
;

При давлении 725 мм рт. ст. и температуре 23 °С один моль газа занимает:
 л.
л.
Таким образом, в расчете на 1 молекулу проходящего через рабочую область газа количество элементарных зарядов, прошедшее через газ составит:


При концентрации СО2 на входе в рабочую область от 0,01 до 0,05 на 1 элементарный заряд, прошедшее через рабочую область за время нахождения там газа количество СО2 приведено в таблице 4.2.
Из этого можно сделать вывод: для построения качественной химической и кинетической модели процессов в рабочей области: каждый ион, проходя через очищаемый газ в том или ином виде должен вызвать порядка не менее 107 актов конверсии С из СО2.
Приведенные (3.76–3.86) энергетические соображения исключают возможность конверсии С из СО2 за счет энергии химических связей компонентов газового потока, поэтому, как было указано, единственным источником энергии служит энергия межмолекулярных взаимодействий молекул паров воды.
Таблица 4.2
Количество молекул СО2, приходящееся
на 1 элементарный заряд ионного тока
| Q (м3) с | 0,25 | 3,75 |
| [CO2] = 0,01 | 0,3·107 | 4,53·107 |
| [CO2] = 0,05 | 1,5·107 | 22,7·107 |
Поэтому, процессы под воздействием электрических зарядов могут идти только через фазу образования отрицательными ионами комплексных соединений, или кластеров, включающих в себя молекулы СО2, «ионы» и молекулы воды.
На роль ионов — носителей отрицательного заряда в газовой среде установки, могут претендовать ионы, во-первых: могущие образовываться в прикатодной области, а, во-вторых — имеющие достаточно большую энергию сродства к электрону (табл. 4.3).
Таблица 4.3
Сродство к электрону ионов рабочей зоны установки В5 [163]
| Ион | Н− | О− | О2− | О3− | Н2О− | СО2− | С− | С2− | ОН− |
| Энергия сродства к электрону, эВ | 0,75 | 1,46 | 0,44 | 2,9 | 0,9 | 3,8 | 1,27 | 3,5 | 1,83 |
Поскольку заметных количеств оксидов азота в рабочей зоне установки не наблюдалось, в первом приближении при построении в основном качественной картины, их вклад мы либо не будем рассматривать, либо отнесем его к возмущенному воздействию на процесс.
Как было указано (3.87–3.93) на разрушение 1 молекулы СО2 до С и О2 необходимо минимум 9 молекул Н2О, при этом должен образоваться кластер из молекулы СО2 и минимум 9 молекул Н2О, имеющий по крайней мере 1 избыточный электрон [159].
В такой конфигурации кластер должен распадаться, разорвав межмолекулярными связями Н2О молекулу СО2 на С и О2, но от него должна отделиться молекула О2. Кроме того, этот кластер должен потерять свой отрицательный заряд, поскольку, как следует из вышесказанного, этот заряд должен будет участвовать в образовании порядка 107÷108 таких кластеров.
Кроме того, полученные кластеры из молекул воды и атомарного углерода должны успеть соединиться в большие по размеру, снова получить заряд и электрическим полем рабочей области должны быть осаждены на аноде.
Таким образом, можно предложить следующий механизм цепочки электрохимических реакций распада оксидов углерода, отвечающий этим требованиям:
1. В прикатодной области образуются ионы Х−, в качестве которых наиболее вероятны: О2−, Н−, ОН−:
е + Х → е Х− (4.38)
2. При столкновении с молекулой СО2 происходит перенос заряда с Х– на СО2.
Х− + СО2 = Х + СО2− (4.39)
3. Далее начинается цепочка прилипания неионизированных молекул воды к полученному иону СО2 –:
СО2− + Н2О → СО2−∙(Н2О) (4.40)
СО2−∙(Н2О) + Н2О → СО2−∙(Н2О)2 (4.41)
……………………………………
СО2−∙(Н2О)7 + Н2О → СО2−∙(Н2О)8 (4.42)
4. Присоединение ещё одной молекулы воды уже энергетически достаточно для диссоциации СО2, однако при этом сохраняется неразрушенным без внешних воздействий:
СО2 −∙ (Н2О)8 + Н2О → [С ∙ (Н2О)9 + О2] −. (4.43)
Для обеспечения объема, конвертируемого в установках типа В конверсии углерода, полученный кластер должен либо потерять электрон, поскольку как было ранее определено, он должен участвовать в 107÷108 актах диссоциации молекул СО2, либо процесс роста кластера должен продолжиться присоединением молекулы воды и недиссоциированных молекул СО2.
Диссоциация СО2 в последнем случае будет происходить в составе кластера. Потеря электрона кластера может произойти только под воздействием внешнего электрического поля, а для этого он должен попасть в область приострийного пространства игл катода, где электрического поля уже достаточно для деионизации кластера, но недостаточно для его полного разрушения.
Рост кластера за счёт присоединения молекул воды может продолжаться до тех пор, пока энергия связи сталкивающейся с ним молекул воды заметно превосходит её тепловую энергию. Предельный объём такого кластера можно оценить, сравнивая эти энергии. Исходя из того, что энергия диполя в поле одного элементарного электрического заряда составляет:
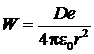 , (4.44)
, (4.44)
где D — дипольный момент молекулы; е — заряд электрона, равный 1,6 . 10–19 К; e0 — 8,85·10–12 ф/м диэлектрическая проницаемость вакуума; r — расстояние от заряда до середины диполя.
Исходя из средней тепловой энергии 3-х атомной молекулы,
W = 3 kT,
k = 1,38 . 10–23 Дж·град–1 — постоянная Больцмана, Т — абсолютная температура и дипольного момента воды D (H2O) = 1,84 Дебая =  К . м, можно получить r = 88·10–10 м.
К . м, можно получить r = 88·10–10 м.
При газокинетическом диаметре Н2О, равном 2,7·10–10 м число молекул воды в полученном кластере может достигнуть
К ~  .
.
Число молекул СО2 в образующемся кластере определяется отношением концентраций СО2 и Н2О и отношением дипольных моментов СО2 и Н2О (1:18).
Полученные комплексные соединения Сs(Н2О)а после потери заряда соответствующими токами, объединяются в более крупные, получают снова избыточный заряд и электрическим полем рабочей области осаждаются на аноде.
4.4. Квантово-химическое исследование
механизмов реакций в газоразрядной системе
Квантовая механика молекул, известная в современной теоретической химии под названием «квантовая химия», обладает в настоящее время мощнейшим математическим программным обеспечением, которое при наличии соответствующей компьютерной техники, позволяет проводить расчеты многих сложных по строению молекул, радикалов, ионов и других образований, электронного строения и реакционной способности практически любых частиц, принимающих участие в химических процессах, в том числе и в условиях газового электрического разряда [190–195].
В основе современной квантовой химии лежит уравнение Шрёдингера для стационарных состояний. Его обычно решают в адиабатическом приближении, т.е. в предположении, что ядерную и электронную волновые функции можно разделить и решать уравнения для движения ядер и электронов раздельно. В этом приближении уравнение Шрёдингера для электронной волновой функции записывается следующим образом [195]:
ĤΨ = Е Ψ, (4.45)
где Ĥ — гамильтониан системы, т.е. сумма операторов кинетической и потенциальной энергий; Ψ = Ψ(х 1, x 2, …, хn) — волновая функция для системы из n частиц, которая зависит от их расположения в пространстве и спинов; Е — полная электронная энергия. Однако точно решить это уравнение удается лишь в случае одноэлектронных систем. Поэтому в квантово-химических расчетах используются приближенные методы. Среди них наиболее широкое распространение получил метод Хартри-Фока [190–195], или метод самосогласованного поля (ССП). В этом методе полагается, что каждый электрон движется в поле атомных ядер, положение которых фиксировано в пространстве, и в эффективном (усредненном) поле других электронов. Многоэлектронную волновую функцию ищут в виде антисимметризованного произведения спин-орбиталей, т.е. одноэлектронных МО φ i (μ), умноженных на спиновые волновые функции α или βсоответствующего электрона:
Ψ = A det[φ1(1)α(1)φ1(1')β(1')…φ n (n ')β(n ')], (4.45)
где 2 n — число электронов в молекуле; μ — номер электрона. Значение коэффициента А определяется условием нормировки |Ψ|2 к единице. В приближении Хартри-Фока уравнение Шрёдингера переходит в систему интегрально-дифференциальных уравнений для движения каждого отдельного электрона:
F φ i = ε i φ i, (4.46)
где F — фокиан (гамильтониан в приближении ССП), ε i — энергии МО.
Молекулярные орбитали φ i (μ) обычно ищут в виде линейных комбинаций атомных орбиталей (ЛКАО) χ i (μ)
φ m (μ) = ∑C mi χ i (μ), (4.47)
где Cmi — искомые коэффициенты.
Таким образом, совокупность атомных орбиталей (АО) χ i является физически наглядным базисом для построения молекулярной волновой функции φ m. Обычно количество базисных АО недостаточно велико, т.е. базис является неполным. Основное требование к неполному базисному набору АО заключается в том, чтобы он мог достаточно точно передать распределение электронной плотности в молекуле, т.е. базис должен быть достаточно сбалансированным. К сожалению, на практике выполнить это условие бывает трудно. Атомные орбитали хорошо аппроксимируют распределение электронной плотности в изолированных атомах, но их использование при расчетах волновых функций молекул может приводить к погрешностям, связанным с неспособностью передать некоторые особенности изменения электронного распределения при образовании валентных связей. Поэтому в случае молекул приходится расширять атомные базисные наборы χ i путем включения в них дополнительных функций [195].
Для определения коэффициентов Cmi , используется вариационная процедура минимизации полной электронной энергии молекулы Е. Рутан показал, что коэффициенты Cmi, соответствующие минимальной величине, могут быть определены из следующей системы уравнений:
 , (4.48)
, (4.48)
где
 ;
;
условие нормировки  .
.
Суммирование ведется по всем базисным орбиталям χ i, χ j, χ k и χl; S ij — интервал перекрывания АО χ i и χ j, F ' ij — матричный элемент одноэлектронного гамильтониана, в который включены кинетическая энергия электронов и энергия взаимодействия электронов и атомных ядер; Pkl — матрица зарядов и порядков связей; < ij | kl > — интеграл кулоновского взаимодействия двух электронов [190–195].
Для решения нелинейной системы уравнений (4.48) применяется метод самосогласования, в котором в качестве нулевого приближения берется совокупность коэффициентов Cmi, причем выбор их может быть произвольным. По коэффициентам нулевого приближения строят матрицу Fij; по ней, решая уравнения (4.48), находят набор коэффициентов Cmi, который используют для построения новой матрицы Fij и т.д., пока матричные элементы Fij и коэффициенты Cmi не перестанут изменяться.
На практике обычно пользуются как полуэмпирическими, так и неэмпирическими методами. Они различаются методикой вычисления матричных элементов, описывающих взаимодействие электронов между собой и электронов и атомных ядер в уравнениях (4.48). В полуэмпирических методах для этой цели используются приближенные эмпирические формулы и известные из эксперимента параметры атомов. В неэмпирических методах проводится непосредственный аналитический расчет матричных элементов. Название «неэмпирический» является синонимом слова «точный», но в действительности это не так. Неэмпирические методы также являются приближенными, прежде всего из-за неполноты использованного базиса.
Большинство неэмпирических расчетов проводят в базисах небольшого и среднего размеров. Это вносит существенную ошибку в результаты расчета, так как такие базисные наборы не могут передать некоторые особенности распределения электронной плотности в молекулах. В результате все без исключения параметры молекул вычисляются с некоторой ошибкой. Было бы желательно (хотя на практике это сделать очень трудно из-за больших затрат машинного времени) использовать достаточно большие базисы, которые обеспечивают выход на так называемый Хартри-Фоковский предел, когда дальнейшее увеличение числа базисных орбиталей не влияет на полученные результаты. Но даже в этом случае мы найдем не точное решение уравнения Шрёдингера, а лишь его решение в приближении Хартри-Фока. Для получения точного решения уравнения Шрёдингера необходимо еще учесть электронную корреляцию.
Полуэмпирические расчеты в настоящее время чаще всего проводят в валентных приближениях CNDO, INDO и NDDO [190–195].
В перечисленных выше приближениях волновые функции рассчитывают только для валентных электронов, а электроны внутренних оболочек включают в остов молекулы; используют минимальный слейтеровский базис; пренебрегают некоторой частью матричных элементов кулоновского взаимодействия электронов. Последнее допущение является наиболее существенным, так как оно позволяет значительно упростить расчет. Количество матричных элементов кулоновского взаимодействия электронов очень велико, оно пропорционально числу базисных орбиталей в четвертой степени, поэтому при увеличении базиса в 2 раза необходимо вычислить в 16 раз больше кулоновских интегралов.
Параметры, которые используются в методах MINDO/2, MINDO/3, MNDO, AM1 и РМ3 для оценки величины матричных элементов, подобраны так, чтобы воспроизвести геометрию и теплоты образования органических соединений. Кроме геометрии и теплот образования, эти методы позволяют неплохо вычислить потенциалы ионизации и дипольные моменты молекул, а также геометрию переходных состояний и энергии активации. В настоящее время их довольно широко используют для расчета поверхностей потенциальной энергии органических реакций. В большинстве случаев получаются удовлетворительные результаты. При вычислении геометрии и относительной стабильности интермедиатов и переходных состояний метод MNDO обычно дает лучшее согласие с экспериментом по сравнению с методами MINDO/2 и MINDO/3. Это связано, по-видимому, с более точным учетом кулоновского взаимодействия электронов.
Метод AM1 отличается от MNDO способами подбора параметров и формулой для вычисления энергии отталкивания остова. За счет более совершенной методики подбора параметров удается немного повысить точность вычисления теплот образования молекул, содержащих атомы кислорода и азота. За счет изменения формулы для вычисления энергии отталкивания остова удалось несколько улучшить согласие с экспериментом при расчете межмолекулярных взаимодействий. Однако количественное улучшение согласия с экспериментом, которое при этом получается, по имеющимся в настоящее время данным, невелико.
В неэмпирических методах все матричные элементы взаимодействия электронов и атомных ядер и электронов между собой вычисляются с помощью аналитического расчета необходимых интегралов в некотором базисе АО. Наиболее точно распределение электронной плотности в атомах можно передать с помощью слейтеровских АО, т.е. функций типа ехр(-α r), r ехр(–α r), х ехр(–α r), y ехр(–α r) и т.д. Однако со слейтеровскими орбиталями очень трудно вычислить интегралы, которые входят в фокиан для молекул. Поэтому в качестве базисных АО обычно берут гауссовы функции:
- для s -орбиталей: ехр(–α r 2);
- для p -орбиталей: x ехр(–α r 2), y ехр(–α r 2), z ехр(–α r 2);
- для d -орбиталей: x 2exp(–α r 2), y 2exp(–α r 2), z 2exp(–α r 2), xy exp(–α r 2), xz exp(–α r 2), yz exp(–α r 2).
Это так называемые примитивные гауссовые функции. С ними относительно легко вычислять матричные элементы, но, когда их мало, они плохо воспроизводят распределение электронной плотности в атомах и молекулах. В связи с этим гауссовых орбиталей приходится брать намного больше, чем слейтеровских. Обычно используют так называемые сгруппированные базисы, в которых каждая базисная орбиталь представляет собой линейную комбинацию из нескольких примитивных гауссовых функций.
В настоящее время для изучения реакционной способности и строения органических соединений наиболее широко используются базисы, предложенные Д.Поплом: минимальный базис STO‑3G, валентно-расщепленные базисы 3-21G, 4-31G, 6-31G, валентно-расщепленные базисы с поляризационными орбиталями 6-31G* и 6-31G**, валентно-расщепленные базисы с диффузными s - и p -орбиталями 3-21+G и 4-31+G [190–195].
STO-3G — минимальный базис, в котором каждая слейтеровская орбиталь аппроксимирована линейной комбинацией из трех гауссовых функций.
3-21G, 4-31G, 6-31G — валентно-расщепленные базисы, в которых каждая слейтеровская орбиталь для электронов внутренних оболочек аппроксимирована линейной комбинацией соответственно из трех, четырех и шести гауссовых функций, а для валентных электронов вместо каждой слейтеровской орбитали используются две линейные комбинации гауссовых функций: одна — из двух (базис 3-21G) или трех (базисы 4-31G и 6-31G), а другая — из одной примитивной гауссовой функции. В этих трех базисах одинаковое число сгруппированных гауссовых функций, но число примитивных функций в базисах 6-31G и 4-31G больше, чем в базисе 3-21G.
Использование базисов 6-31G и 4-31G позволяет получить более точную аппроксимацию распределения электронной плотности, особенно вблизи атомных ядер, однако точность результатов при вычислении большинства физико-химических параметров молекул повышается незначительно, а затраты машинного времени возрастают существенно (наиболее сильно в расчетах с оптимизацией геометрии). Поэтому в прикладных работах в настоящее время наиболее широко используется базис 3-21G.
6-31G* и 6-31G** — валентно-расщепленные базисы с поляризационными d -орбиталями. В базис 6-31G* включены поляризационные d -орбитали на р -элементах, т.е. на атомах углерода, азота и т.д., а в базис 6-31G** — d -орбитали на р -элементах и р‑ орбитали на атомах водорода. Включение в базис поляризационных орбиталей существенно повышает точность расчета, но, к сожалению, при этом очень сильно возрастают затраты машинного времени.
3-21+G и 4-31+G — с дополнительными диффузными s - и р‑ орбиталями — используются в квантово-химических расчетах физико-химических параметров анионов. При образовании аниона из электрически нейтральной молекулы МО становятся более диффузными. Этот эффект не удается передать при использовании валентно-расщепленных базисов, подобранных для расчета незаряженных молекул, поэтому точность неэмпирического расчета для анионов в таких базисах оказывается существенно ниже, чем для нейтральных соединений. Повышение точности может быть достигнуто за счет дополнительного включения в базис диффузных s - и p -орбиталей. Это наиболее экономичный способ повышения точности неэмпирических расчетов для анионов. Затраты машинного времени при этом возрастают лишь в 1,5 раза. При изучении анионов можно также использовать базисы с поляризационными орбиталями, так как d -орбитали на р -элементах и р -орбитали на атомах водорода являются диффузными функциями, но в этом случае затраты машинного времени на выполнение расчета возрастают сильнее.
Таким образом, мы видим, что все неэмпирические квантово-химические методы являются в большей или меньшей степени приближенными и их результаты очень сильно зависят от выбора базиса. Увеличение числа базисных функций обычно позволяет точнее передать распределение электронной плотности в молекулах и его изменение в ходе химических реакций. Вообще говоря, желательно расширять базис до выхода на хартри-фоковский предел. Однако сделать это удается лишь для простейших молекул. Для более сложных соединений приходится идти на компромисс между точностью расчета, с одной стороны, и затратами машинного времени. Поэтому при изучении таких соединений приходится ограничиваться базисами среднего и даже минимального размеров, но тогда в расчет вносится значительный элемент произвола и теряется его универсальность, т.е. оказывается, что различные параметры молекул нужно рассчитывать в разных базисах.
Кроме того, использование приближения Хартри-Фока (метода ССП) также может вносить немалую ошибку в результаты расчета. В этом приближении вероятность найти электрон в некоторой точке пространства не зависит от местонахождения других электронов, распределение в пространстве которых задано одноэлектронными волновыми функциями. В результате двум электронам с одинаковыми спинами не запрещено занимать одну и ту же точку пространства. В действительности электроны с одинаковыми спинами стремятся избежать нахождения не только в одной точке пространства, но даже близко друг от друга. Другими словами, электроны движутся зависимо, т.е. их движение носит коллективный характер. Пренебрежение этим эффектом, который принято называть электронной корреляцией, приводит к существенному завышению энергии взаимодействия электронов и, как следствие, завышению полной энергии молекулы.
Вместе с тем следует отметить, что, несмотря на сложную математическую природу путей решения дифференциального уравнения Шредингера для систем из многих частиц, какими являются молекулы, а тем более их химические реакции, современные программные квантово-химические продукции как HYPERCHEM, MOPAC, GAMESS или GAUSSIAN, ориентированные на потребителя-нематематика, обладает достаточной простотой в обращении благодаря прекрасным инструкциям по использованию указанных программных продукций различных фирм. При этом большинство из указанных квантово-химических программных пакетов обладают графическими драйверами с большими возможностями для пиктографического конструирования молекулярных структур и различных реакционных систем [192].
 2017-12-14
2017-12-14 1398
1398








