Характерні реакції за участю карбоксильної групи, в тому числі вияв кислотних властивостей, та реакції за участю вуглеводневого радикала: зміщення атомів Гідрогену біля α- карбонового атома.
| Реакції за участю карбоксильної групи | ||||||||||
| Кислотні властивості: розчинні кислоти – слабкі електроліти, в гомологічному ряді сила зменшується зі збільшенням вуглеводного радикала, отже, найсильніша карбонова кислота – мурашина. | ||||||||||
| Дисоціюють у водних розчинах з утворенням катіона Гідрогену та аніона кислотного залишку. Змінюють забарвлення індикаторів. |     R – COOH R – COOH  R – C R – C  + +  | |||||||||
| Властивості, спільні для органічних і неорганічних кислот | ||||||||||
| Умови перебігу реакції | Продукти реакції | Приклади рівнянь реакції | ||||||||
| Взаємодія з металами, розташованими зліва від водню в електрохімічному ряді напруг металів | Сіль і водень |
 Mg + Mg + 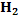 ↑ ↑ | ||||||||
| Взаємодія з основними та амфотерними оксидами | Сіль і вода |
 | ||||||||
| Взаємодія з основними та амфотерними гідроксидами | Сіль і вода |
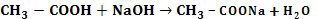 | ||||||||
| Взаємодія з солями | Сіль і летка (або більш слабка кислота) |  | ||||||||
| Властивості, характерні тільки для органічних кислот | ||||||||||
| Утворення естерів (складних ефірів) Взаємодіють зі спиртами у присутності неорганічних кислот (відбувається оборотна реакція естерифікації) |
|  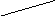   
    
     | ||||||||
| Умови перебігу реакції | Продукти реакції | Приклади рівнянь реакції | ||||||||
| Утворення ангідридів При нагріванні у присутності водовід’ємних речовин дві молекули кислоти відщеплюють воду з утворенням ангідриду кислоти | Ангідрид кислоти і вода |
   | ||||||||
| Реакція заміщення Гідрогену при α-карбоновому атомі | ||||||||||
| Взаємодія з галогенами (хлором або бромом) у присутності червоного фосфору | α–галогенкарбонові кислоти за будь-якої довжини вуглеводневого радикала |     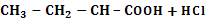
 | ||||||||
| Специфічні властивості мурашиної кислоти | ||||||||||
| Вступає в реакцію «срібного дзеркала» по альдегідній групі | Вугільна кислота та металічне срібло |
   H – C H – C  + +  → →
→ 2Ag↓ + | ||||||||
| Розкладається при нагріванні | Карбон (IV) оксид і водень |     H – C H – C   | ||||||||
| Розкладається при нагріванні з концентрованою сульфатною кислотою | Карбон (II) оксид і вода |   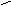  H – C H – C  CO↑ + CO↑ +  | ||||||||
Застосування:
– Мурашина кислота – протрава при фарбуванні вовни; для консервації фруктових соків; відбілювач; дезінфекційний препарат.
– Оцтова кислота – сировина в промисловому синтезі барвників, медикаментів, органічного скла; розчин оцтової кислоти (3-8%) – у харчовій промисловості та у побуті як смаковий та консервувальний засіб (столовий оцет).
 2017-12-14
2017-12-14 1601
1601


 ↑ +
↑ +