Теплота и работа
Изменение состояния термодинамической системы при ее взаимодействии с внешней средой можно осуществить путем теплообмена или совершением работы.
Процесс передачи энергии системе от внешних тел, называют работой.
Процесс обмена внутренними энергиями соприкасающихся тел, без совершения работы, называют теплообменом.
Количество переданной энергии системе внешними телами путем теплообмена, называют теплотой (количеством теплоты).
Например, работу над газом, находящимся в цилиндре под поршнем, производят силы давления со стороны внешних сил (рис. 3.1).
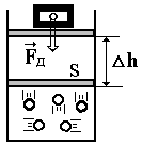
Рис. 3.1
Работа А*, совершаемая внешними телами над системой, численно равна и противоположна по знаку работе А, совершаемой системой над внешними телами, т.е. А = - А*.
По определению, давление
Р = Fд / S.
Из механики известно, что работа А* = FдDh. Тогда
| А* = Р (Dh S) = P DV. | (3.1) |
В процессе совершения работы над системой происходит изменение параметров, характеризующих ее состояние, например, давления, объема, температуры.
Изменить параметры состояния системы можно при теплообмене за счет передачи тепла от одного нагретого тела другому.
Теплота - это не заключенная в теле энергия, а то количество энергии, которое передается от горячего тела холодному.
Таким образом, теплота и работа являются различными формами передачи энергии от одного тела другому. Процессы работы и теплоты качественно различны. Совершение работы над системой может привести к изменению любого вида энергии: кинетической, потенциальной и т.д. Если энергия сообщается системе в форме теплоты, то она идет на увеличение энергии теплового движения частиц системы, называемой внутренней энергией U системы.
Часто оба способа передачи энергии системе могут осуществляться одновременно. Например, при нагревании газа в сосуде с подвижным поршнем. Для перевода системы из одного состояния в другое, с помощью различных термодинамических процессов, ей нужно сообщить различные количества теплоты. Следовательно, теплота и работа, являются функциями процесса изменения состояния системы. Поэтому элементарное количество теплоты, сообщенное системе в процессе бесконечно малого изменения ее состояния, подобно элементарной работе и не является полным дифференциалом.
Полная энергия термодинамической системы включает в себя сумму всех видов энергии частиц, входящих в систему:
1) Кинетическую энергию хаотического движения атомов и молекул (поступательную, вращательную и колебательную энергии).
2) Потенциальную энергию взаимодействия атомов и молекул.
3) Энергию электронных оболочек атомов и ионов.
4) Энергию взаимодействия протонов и нейтронов в ядрах атомов и другие виды энергий.
Во всех процессах, не связанных с химическими реакциями и другими изменениями конфигурации электронных оболочек атомов и ионов, а также с ядерными реакциями в веществах, их энергии не изменяются и не влияют на изменение внутренней энергии.
Внутренняя энергия идеального газа определяется только средней кинетической энергией теплового хаотического движения всех молекул. Изменение внутренней энергии при переходе системы из состояния 1 в состояние 2 не зависит от вида процесса перехода, а определяется только параметрами начального и конечного состояний, т.е.
| DU=U2-U1. | (3.2) |
Следовательно, внутренняя энергия является функцией состояния системы.
Работа и теплота зависят от вида процесса перехода системы из состояния 1 в состояние 2. Поэтому работа в тепловых процессах на замкнутом пути не равна нулю. Действительно, пусть система (идеальный газ) переходит из состояния 1 в состояние 2 и обратно в результате двух различных равновесных процессов.
Графически можно изобразить только равновесные процессы.
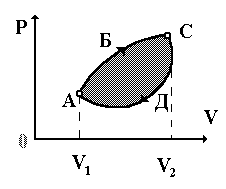
Рис. 3.2
На P - V диаграмме (рис. 3.2) одному из них соответствует кривая А-Б-С. Работа на этом участке
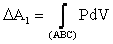 , ,
| (3.3) |
где давление Р изменяется вдоль кривой А-Б-С.
Работу равна площади криволинейной трапеции, ограниченной сверху кривой А-Б-С.
Другому процессу соответствует кривая А-Д-С, т.е. работа
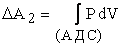 , ,
| (3.4) |
где давление Р изменяется вдоль кривой А-Д-С.
Эта работа равна площади криволинейной трапеции, ограниченной сверху кривой А-Д-С.
Полная работа не равна нулю, т.е.
DА = DА1 - DА2¹ 0.
Следовательно, она численно равна площади фигуры, ограниченной кривыми А-Б-С-Д-А.
В чем различие между температурой, теплотой и внутренней энергией?
1. Температура - мера средней кинетической энергии отдельных молекул или мера отклонения системы от термодинамического равновесия.
2. Теплота - количество энергии, переданной от одного тела другому.
Существуют три вида теплообмена: конвекция, излучение, теплопроводность.
а) Излучение - процесс передачи энергии путем теплообмена без совершения механической работы называют излучением.
Для передачи теплоты путем излучения не требуется вещество, как средство передачи теплоты от одного тела другому.
Само существование жизни на Земле возможно только за счет получения энергии от Солнца.
Кванты солнечного света непрерывным потоком устремляются к Земле неся животворную энергию.
На долю Земли приходится около 0,2 % всей энергии излучения Солнца (ежесекундно Земля получает примерно 2 кг фотонов). Остальные 99,8 % энергии излучения Солнца включены во всеобщую галактическую энергию и энергию всей Метагалактики.
Степень поглощения излучения зависит от состояния поверхности и материала тела.
б) Конвекция.
Процесс передачи теплоты за счет перемещения молекул из одной части объема в другую называют конвекцией.
Хотя газы и жидкости являются плохими проводниками теплоты, тем не менее они могут обеспечить довольно быструю передачу ее на значительные расстояния благодаря существованию конвекции. Различают конвекцию естественную и вынужденную.
Например, нагретый атмосферный воздух поднимается вверх, а холодный опускается вниз.
Вблизи батарей радиаторов отопления или других нагревателей нагретый воздух расширяется, его плотность уменьшается, что и приводит к его подъему вверх помещения.
Крупномасштабные проявления естественной конвекции наблюдаются на примере океанских или морских течений (например, Куросиво, Гольфстрим и др.). Ветер - один из примеров явления конвекции, вызывающий изменение погодных условий.
Возникновение конвективных потоков в сосуде с водой при ее нагревании приведены на рис. 3.3.
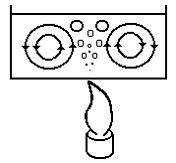
Рис. 3.3
Теплопроводность будет рассмотрена в разделе "Явления переноса".
3. Внутренняя энергия - полная энергия всех молекул газа [см. п.1.7].
Например, у двух нагретых медных цилиндров равной массы, имеющих одинаковые температуры
внутренняя энергия двух вместе взятых цилиндров будет больше каждого из них в отдельности.
Количество же теплоты передаваться не будет, т.к. температуры одинаковы.
Или, если смешать 100 г воды при температуре 50 0С с 200 г воды при температуре 20 0С, то количество теплоты будет переходить от воды с температурой 50 0С к воде с температурой 20 0С, хотя внутренняя энергия воды при 20 0С больше из-за большей массы.
 2017-12-14
2017-12-14 468
468