Техническая работа
Внутренняя энергия. Известно, что эквивалентность теплоты и работы является опытным подтверждением всеобщего закона сохранения и превращения энергии, согласно которому энергия не исчезает и не возникает вновь, она лишь переходит в разлитых физических (а также химических) процессах из одного вида к другой.
Закон сохранения и превращения энергии в применении к понятиям термодинамики носит название первого закона термодинамики.
Опыт показывает, что подвод теплоты Q к какому-либо телу гак же, как и отвод теплоты) обычно связан с изменением температуры тела Т и его объема V.
Изменение температуры обусловлено изменением энергии движения молекул вещества. Этот вид энергии называется внутренней энергией, под которой понимается сумма кинетической и потенциальной энергий атомов и молекул тела. В общем случае внутренняя энергия тела складывается из кинетической энергии поступательного, вращательного и колебательного движения молекул, потенциальной энергии сил сцепления (отталкивания) между молекулами, внутримолекулярной, внутриатомной и внутриядерной энергии.
Если количество внутренней энергии рабочего тела до начала подвода теплоты к этому телу обозначить через U 1 ъ а количество внутренней энергии этого же тела после окончания подвода теплоты — через U 2, то результатом процесса будет изменение внутренней энергии:
Для определения разности D U нет необходимости знать, по какому закону происходит подвод теплоты к телу. Поэтому внутренняя энергия тела может быть отнесена к группе параметров состояния.
Первый закон термодинамики. Изменение объема тела при нагревании (или охлаждении) связано с работой, которую производят возникающие в этом процессе силы, проявляющиеся в форме давления на поверхность тела. Работа этих сил в процессе подвода теплоты Q называется внешней работой L. Отсюда следует, что затрата теплоты Q при изменении температуры и объема тела связана с изменением внутренней энергии AU и совершением внешней работы L, следовательно, в соответствии с законом сохранения энергии

Соотношение (2.1) называют обычно аналитическим выражением первого закона термодинамики для неподвижного тела. Это соотношение устанавливает, что в данном термодинамическом процессе теплота расходуется в двух направлениях: на изменение внутренней энергии и на совершение внешней работы.
В технической термодинамике принимают, что основной формой преобразования теплоты во внутреннюю энергию является изменение кинетической энергии движения молекул (как функции изменения температуры) и потенциальной энергии сил сцепления между молекулами (как функции изменения удельного объема): U = f (T, v).
Для идеальных газов силы сцепления между молекулами равны нулю, следовательно, внутренняя энергия таких газов зависит только от их абсолютной температуры: U = f (T).
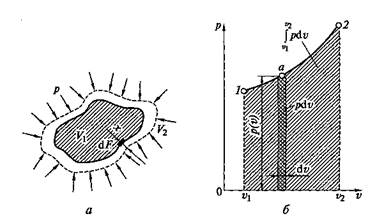
Рис. 2.1. Изменение объема газа в процессе расширения (а) и графическое изображение работы расширения (сжатия) на р—v -диаграмме (б)
Работа расширения (сжатия) неподвижного тела проявляется в изменении объема тела V под действием давления p. Например, если к газу, занимающему объем V1(рис. 2.1, а) при давлении среды р, подвести некоторое количество теплоты Q, то можно наблюдать увеличение объема газа до величины V 2. Каждый элемент объема под действием давления р переместится при этом на величину х. Так как давление всегда направлено по нормали к поверхности, то сила, действующая на элемент поверхности dF, будет равна pdF, а элементарная работа на пути х
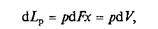
где dV= dFx —- элементарный объем.
Очевидно, полная работа для всей поверхности тела при изменении объема от Vx до V2
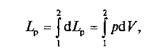
или для 1 кг газа
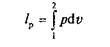
и

Работа расширения как функция давления и объема может быть графически изображена в координатах p и v (рис. 2.1, б). Если в данном процессе зависимость давления от объема изображается кривой 1—2, то для элементарного объема dv величина элементарной работы d I p может быть выражена элементарной площадкой d I p = pdv, а вся работа расширения при изменении объема 1 кг газа от v 1до v 2 определяется по формуле
и равна площади, ограниченной линией процесса 1—2 и осью абсцисс.
Уравнение первого закона термодинамики, устанавливающего связь между подведенной к телу теплотой, изменением внутренней энергии и внешней работой, при расчете на единицу массы примет следующий вид:

или в дифференциальной форме
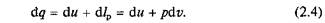
Техническая работа. Если теплота сообщается движущемуся в пространстве телу, например потоку газа или пара, текущему по каналу произвольной формы, то получаемая при этом внешняя работа, кроме работы расширения, включает еще и другие виды механической энергии. Так, если 1 кг газа или пара движется (рис. 2.2, а)от сечения 1—1 к сечению 2—2 со скоростью, изменяющейся от с 1до с 2, то в этом случае наблюдается изменение кинетической энергии от I 1= с 12 /2 до I 2 = с 22 /2. Кроме того, подходя к сечению 1—1 (или покидая сечение 2—2), каждый элемент объема вытесняет равный ему объем вещества, т.е. совершает так называемую работу проталкивания.
По аналогии с работой расширения можно получить, что теплота, подводимая к движущему телу (газу или пару),
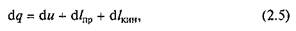
где dи — изменение внутренней энергии; d I np — изменение работы проталкивания; d Iк ин —- изменение кинетической энергии.
Уравнение (2.5) является аналитическим выражением первого закона термодинамики для потока газа.
Изменение кинетической энергии потока называют его технической работой I техн = D I кин. Из уравнения (2.4) после ряда замен и преобразований получаем
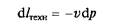
(знак минус указывает на уменьшение объема при росте значений давления).
В итоге полная техническая работа (рис. 2.2, б), совершаемая в процессе 1—2,
определится как площадь, ограниченная линией процесса 1—2 и осью р (напомним, что величина I р определялась как площадь, ограниченная линией процесса и осью v),
2,3* Теплоемкость, энтальпия и энтропия. Второй закон термодинамики
Теплоемкость и ее виды. Удельной теплоемкостью с называют количество теплоты q, которое требуется для изменения температуры единицы количества вещества на один градус: с = q/ D T; с = d q/ d T.
В зависимости от способа измерения единицы количества вещества, характера термодинамического процесса и величины интервала температур различают несколько видов теплоемкостей.
1. В зависимости от единицы количества вещества — 1 кг, 1 м3, 1 кмоль — теплоемкость бывает массовой с [Дж/(кг×К)], объемной с' [Дж/(м3×К)] и молярной µ с [Дж/(кмоль×К)].
Связь между ними выражается зависимостью
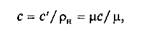
где rн — плотность вещества при нормальных физических условиях.
Количество теплоты определяется по формуле
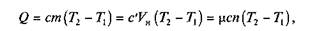
где т —- масса газа; V н — объем газа, приведенный к нормальным физическим условиям; п— число молей газа.
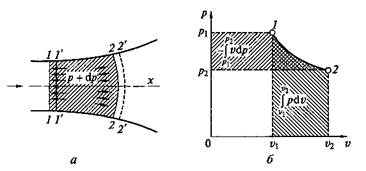
Рис. 2.2. Внешняя работа движущегося газа (а)и графическое изображение технической работы на р— v-диаграмме (б)
2. Теплоемкость зависит от характера процесса и свойств газа. В зависимости от способа подвода теплоты различают теплоемкость при постоянном давлении (изобарную) ср и теплоемкость при постоянном объеме (изохорную) cv.
Еще в 1842 г. один из основоположников закона сохранения и превращения энергии Ю. Р. Майер установил, что
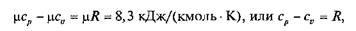
где R — газовая постоянная,
Отношение k = cp/cv называют показателем адиабаты.
3. Поскольку теплоемкость изменяется с температурой, в зависимости от интервала температур различают истинную с и среднюю ст удельные теплоемкости. Истинной называют теплоемкость с = d q/ d T, соответствующую бесконечно малому интервалу температур, а средней — теплоемкость ст = q/ (T 2– T 1), соответствующую конечному интервалу изменения температуры.
При практических расчетах обычно пользуются табличными данными средних теплоемкостей в интервале температур от 0 до t°C. В этом случае количество теплоты, требующееся для нагрева 1 кг рабочего тела от 0 до t 1или до t 2:
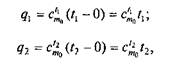
где с t1m о и с t2m о — табличные значения теплоемкостей в интервалах температур (0 ...t 1 ) и (0... t 2).
Количество теплоты, необходимое для нагрева 1 кг тела от t 1до t2, определяется следующим образом:
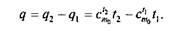
Энтальпия. В ряде случаев оказывается целесообразным объединение параметров и и pv в общий калорический параметр, называемый энтальпией, Дж/кг:

Энтальпия — термодинамическая функция, имеющая смысл полной (внутренней и внешней) энергии системы. Она складывается из внутренней энергии и иупругостной энергии pv, обусловленной наличием внешнего давления окружающей среды р, т.е. pv — работа, которую надо затратить, чтобы ввести рабочее тело объемом v в среду, имеющую давление р.
Для идеального газа справедливы соотношения:
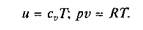
Продифференцировав выражение i = и + pv и подставив в дифференциальное уравнение первого икона термодинамики (2.4), для потока рабочего тела можно получить:
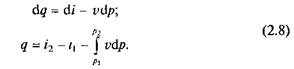
Энтальпия измеряется в тех же единицах, что и теплота, работa и внутренняя энергия (Дж/кг).
Второй закон термодинамики. Второй закон термодинамики, как и первый, является опытным законом, основывающимся на многовековых наблюдениях ученых. Однако установлен он был только в середине XIX в.
Наблюдения за явлениями природы показывают, что возникновение и развитие самопроизвольно протекающих в ней естественных процессов, работа которых может быть использована для нужд человека, возможно лишь при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой. Эти процессы всегда характеризуются односторонним их протеканием от более высокого потенциала к более низкому (от более высокой температуры к более низкой или от более высокого давления к более низкому). При протекании указанных процессов термодинамическая система стремится к тому, чтобы прийти в равновесие с окружающей средой, характеризуемое равенством давления и температуры системы и окружающей среды.
Из наблюдений за явлениями природы следует также, что для того чтобы заставить процесс протекать в направлении, обратном направлению протекания самопроизвольного процесса, необходимо затратить заимствуемую из внешней среды энергию.
Второй закон термодинамики представляет собой обобщение изложенных выше положений и заключается в следующем.
1. Самопроизвольное протекание естественных процессов возникает и развивается при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой.
2. Самопроизвольно происходящие в природе естественные процессы, работа которых может быть использована человеком, всегда протекают лишь в одном направлении от более высокого потенциала к более низкому.
3. Ход самопроизвольно протекающих процессов происходит в направлении, приводящем к установлению равновесия термодинамической системы с окружающей средой, и по достижении этого равновесия процессы прекращаются.
4. Процесс может протекать в направлении, обратном самопроизвольному процессу, если энергия для этого заимствуется из внешней среды.
Из второго закона термодинамики вытекает следующее: для того чтобы работала периодически действующая машина, необходимо, чтобы были минимум два источника теплоты различной температуры; при этом в работу может быть превращена лишь часть теплоты, забираемой из высокотемпературного источника, в то время как другая часть теплоты должна быть передана низкотемпературному источнику.
Энтропия. В термодинамике пользуются еще одним параметром состояния рабочего тела — энтропией, устанавливающей связь между количеством теплоты и температурой (Р. Клаузиус, 1850 г.). Поясним этот параметр исходя из следующих соображений.
Уравнение первого закона термодинамики можно записать в виде
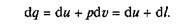
В этом уравнении dq не является полным дифференциалом, поскольку в правую часть уравнения входит член dI, не являющийся полным дифференциалом, так как работа является не параметром состояния газа, а функцией процесса.
Из математики известно, что всякий двучлен можно представить в виде полного дифференциала, если его умножить на так называемый интегрирующий множитель.
При умножении на интегрирующий множитель 1/Т (где Т — абсолютная температура) приведенное выше уравнение примет вид

Уравнение (2.9) можно представить в несколько ином виде, а именно:
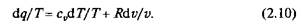
Выражение (2.10) говорит о том, что dq/T представляет собой полный дифференциал некоторой функции s (т.е. dq/T=ds), являющейся параметром состояния газа, поскольку она зависит только от двух параметров состояния газа и поэтому не зависит от того, каким путем газ из одного состояния перешел в другое. Этот параметр состояния газа в общем случае называют энтропией газа, обозначают буквой S (Дж/К). Энтропию, отнесенную к 1 кг газа, называют удельной энтропией газа и обозначают буквой s [Дж/(кг К)].
Следовательно, можно записать:
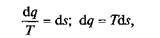
или полное количество теплоты в термодинамическом процессе

Этот интеграл можно вычислить, если известна функциональная зависимость между Т и s. Пользуясь этой зависимостью, в координатах Т, s строят кривые, отображающие те или иные термодинамические процессы.
На основании выражения (2.11) можно заключить, что для процесса 1—2 (рис. 2.3) площадь 1—2 — s2—s1,лежащая под кривой, отображающей этот процесс, выражает количество теплоты, участвующее в этом процессе.
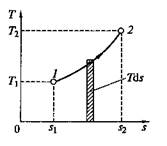
Рис. 2.3. Графическое изображение подвода теплоты на Т— s-диаграмме
Физический смысл энтропии. Энтропию нельзя измерить, ее смысл затруднительно продемонстрировать с помощью наглядных пособий, но можно понять по следующим интерпретациям.
1. Энтропия – мера ценности теплоты, ее работоспособности и технологической эффективности.
2. Энтропия – мера потери работы вследствие необратимости реальных процессов. Чем более необратим процесс в изолированной системе, тем больше возрастает энтропия (s2>> s1)и тем большая доля энергии не превращается в работу, рассеивается в окружающую среду.
3. Энтропия – мера беспорядка. Если установить некоторую меру неупорядоченности макросистемы — неупорядоченности расположения и движения частиц D, то можно записать s = k ln D, где к — коэффициент пропорциональности.
Следовательно, возрастание беспорядка означает возрастание энтропии, рассеивание энергии. При подводе теплоты увеличивается хаотичность теплового движения частиц и энтропия возрастает. Охлаждение системы при постоянном объеме есть извлечение из нее теплоты, а следовательно, и энтропии. Упорядоченность системы при этом повышается, а энтропия уменьшается. Такая закономерность позволяет предположить, что если абсолютная температура станет равной нулю и тепловое движение полностью прекратится, то в системе установится максимальный порядок, т.е. неупорядоченность и энтропия станут равными нулю. Это предположение, не поддающееся опытной проверке, ибо абсолютный нуль температуры недостижим, носит название третьего закона термодинамики. Следовательно,
Обратимые термодинамические процессы. Для исследования термодинамических процессов вводят понятия о равновесных (обратимых) процессах. I Состояние рабочего тела, при котором I давление, температура и, следовательно, удельный объем во всех его точках не изменяются без внешнего энергетического воздействия во времени, называется равновесным состоянием.
Последовательное изменение состояния рабочего тела, происходящее в результате энергетического взаимодействия рабочего тела с окружающей средой, называется термодинамическим процессом. Процесс, при осуществлении которого тело последовательно проходит непрерывный ряд состояний равновесия, называется равновесным.
Обратимым процессом называется такой термодинамический процесс, который допускает возможность протекания через одни и те же равновесные состояния как в прямом, так и в обратном направлениях, а в окружающей среде не остается никаких изменений.
В природе и технике обратимые процессы в чистом виде не наблюдаются. Однако их изучение играет большую роль, так как многие реальные процессы близки к обратимым.
2.4. Основные термодинамические процессы идеальных газов
Виды процессов. Основными процессами в технической термодинамике, весьма важными и в теоретическом, и в прикладном отношениях, являются:
изохорный — протекающий при постоянном объеме;
изобарный — протекающий при постоянном давлении;
изотермический — происходящий при постоянной температуре;
адиабатный — при котором отсутствует теплообмен с окружающей средой;
политропный — удовлетворяющий уравнению pvn = const.
Первые четыре процесса являются частными случаями политропного процесса.
При исследовании этих процессов определяют уравнение процесса в координатах р, v и Т, s, связь между параметрами состояния газа, изменение внутренней энергии, величину внешней работы и количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс. При изохорном процессе выполняется условие dv = 0 или v = const. Из уравнения состояния идеального газа следует, что
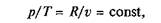
т.е. давление газа прямо пропорционально его абсолютной температуре:
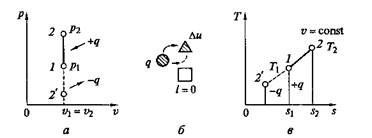
Рис. 2.4. Изохорный процесс на/?—v- и Т— ^-диаграммах (а, в) и схема энергобаланса (б)
Графики процесса на р—v и Т–s-диаграммах, а также схема энергобаланса представлены на рис. 2.4. Работа расширения в этом процессе равна нулю, так как dv = 0. Количество теплоты, подведенной к рабочему телу в процессе 1—2 при cv = const, определяется из соотношения
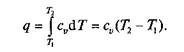
Так как I = 0, то в соответствии с первым законом термодинамики Du = q и Dи = cv (Т2 – Т1)при cv = const.
Изобарный процесс. Изобарным называется процесс, происходящий при постоянном давлении. Из уравнения состояния идеального газа при р = const находим
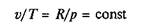
или
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака). Графики процесса на p–v и Т–s–диаграммах, а также схема энергобаланса изображены на рис. 2.5.
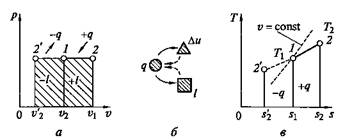
Рис. 2.5. Изобарный процесс на p–v- и Т–s-диаграммах (а, в)
и схема энергобаланса (б)
Из выражения (2.2) следует, что
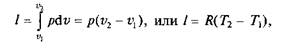
так как 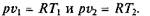
Количество теплоты, сообщаемое газу при нагревании (или отдаваемое им при охлаждении), находим из уравнения
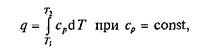
или
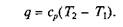
Изотермическим процесс. При изотермическом процессе температура постоянна, следовательно pv = RT = const или р2/р1= v1/v2, т.е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении — падает (закон Бойля –Мариотта).
Графиком изотермического процесса в координатах р,и (рис. 2.6,а)является равнобокая гипербола, для которой координатные оси служат асимптотами.
Работа процесса
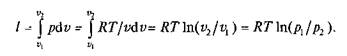
Так как температура не меняется, то внутренняя энергия идеального газа в данном процессе остается постоянной (Du = 0) и вся подводимая к газу теплота полностью превращается в работу расширения: q = I.
Рис. 2.6. Изотермический процесс на p–v и Т–s диаграммах (а, в)и схема энергобаланса (б)
При изотермическом сжатии от газа отводится теплота в количестве, равном затраченной на сжатие работе. Схема энергобаланса и график изобарного процесса на Т–s-диаграмме приведены на рис. 2.6, б, в.
Адиабатный процесс. Адиабатным называется процесс изменения состояния газа, который происходит без теплообмена с окружающей средой. Такой процесс соответствует случаю, когда, сосуд или оболочка, вмещающие в себе газ, изолированы в тепловом отношении от окружающей среды. Для данного случая уравнение первого закона термодинамики, поскольку в нем. по условию Dq = 0, принимает вид
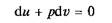
или
откуда
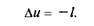
Это означает, что в адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа и что при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через сад и выразим условие dq = 0 следующим образом:
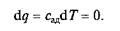
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю, т.е. сад = 0. Известно, что
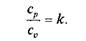
Уравнение кривой адиабатного процесса (адиабаты) в координатах р, v (рис. 2.7,а)имеет вид
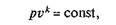
где к называется показателем адиабаты (эту величину называют также коэффициентом Пуассона).
Из выражений 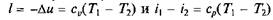 следует, что
следует, что
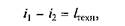
т.е. техническая работа адиабатного процесса расширения равна разности энтальпий начала и конца процесса.
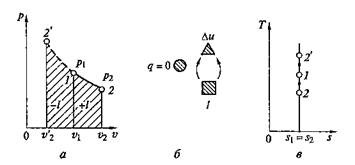
Рис. 2.7. Адиабатный процесс на p–v и T–s-диаграммах (а, б) и схема
энергобаланса (в)
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. На T–s-диаграмме (рис. 2.7,в)он изображается вертикальной прямой.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате которого всегда выделяется теплота, которая тут же сообщается самому рабочему телу. В этом случае ds>0, процесс называется реальным адиабатным процессом.
Политропный процесс и его обобщающее значение. Политропным называется процесс, который описывается уравнением

Показатель политропып может принимать любое численное значение в пределах от –∞ до +∞, но для данного процесса он является величиной постоянной.
Из уравнения (2.13) и уравнения Клапейрона нетрудно получить выражения, устанавливающие связь между р, v и Т в любых двух точках на политропе:
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
2.5. Реальные газы и водяной пар
Реальные газы. К реальным газам в технической термодинамике принято относить перегретые пары некоторых жидкостей. В отличие от воображаемого идеального газа реальный газ при соответствующих условиях может быть сжижен, т.е. сконденсирован, или же переведен в твердое состояние.
В технике широко применяют пары различных веществ: воды, аммиака, хлористого метила, сернистого ангидрида и др. Наибольшее применение имеет водяной пар, являющийся основным рабочим телом паровых двигателей, отопительных и других устройств.
Известно, что законы идеальных газов нельзя распространить на рабочие тела, состояние которых не очень удалено от жидкой фазы.
В связи с этим на водяной пар при давлениях и температурах, обычно применяемых в теплоэнергетике, не распространяется уравнение состояние Клапейрона. Из ряда предлагавшихся уравнений состояния, применимых для него с известной степенью приближенности, можно отметить уравнение Ван-дер-Ваальса, составленное для реальных газов и имеющее вид
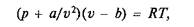
где а и b — постоянные для данного газа.
Слагаемое a/v2 в первом множителе учитывает влияние сил взаимодействия молекул, величина b во втором множителе учитывает влияние объема молекул (поскольку в идеальном газе, для которого и справедливо уравнение состояния Клапейрона, объем молекул полагается равным нулю).
Практически пользоваться уравнением Ван-дер-Ваальса нельзя, так как оно не дает результаты, достаточно точные для нужд современнойпаротехники. Наиболее точным является в настоящее время уравнение состояния реальных газов, разработанное М.П.Вукаловичем и Н.И.Новиковым (МЭИ) применительно в основном к водяному пару. Вывод этого уравнения основан на предположении наличия в реальных газах ассоциаций молекул, механически объединенных в двойные, тройные и более сложные комплексы, образующиеся в результате взаимодействия между ними. Для этого уравнения характерно близкое совпадение результатов расчетов с опытными данными. Однако для практических целей пользование этим, как и другими уравнениями состояния реального газа, неудобно вследствие сложности их и необходимости выполнения трудоемких вычислений. Обычно пользуются готовыми данными, которые берут из таблиц водяного пара пли из i, s-диаграммы водяного пара.
Промежуточное состояние вещества между состоянием реального газа и жидкостью принято называть парообразным, или просто паром. Превращение жидкости в пар представляет собой фазовый переход из одного агрегатного состояния в другое. При фазовом переходе наблюдается скачкообразное изменение физических свойств вещества.
Примерами таких фазовых переходов являются процесс кипения жидкости с появлением влажною насыщенного пара и с последующим переходом ею в лишенный влаги сухой насыщенный пар или обратный кипению процесс конденсации насыщенного пара. Во всех этих фазовых переходах существует однозначная связь между давлением и температурой (в данном примере — связь давления с температурой кипения или конденсации).
Одно из основных свойств сухого насыщенного пара заключается в том, что дальнейший подвод теплоты к нему приводит к возрастанию температуры пара, т. е. переходу его в состояние перегретого пара, а отвод теплоты — к переходу в состояние влажного насыщенного пара. В современной теплоэнергетике основным рабочим телом является водяной пар. Поэтому изучение термодинамических свойств паров рассмотрим на примере водяного пара.
Водяной пар. На рис. 2.8 изображены фазовые состояния воды и водяного пара в координатах Т, s. Здесь может быть выделено несколько областей:
область I — газообразное состояние (перегретый пар, обладающий свойствами реального газа).
область II —- равновесное состояние воды и насыщенного водяного пара (двухфазное состояние), двухфазную область //называю также областью парообразования;
область III, ограниченная изотермой ЕК, — жидкое состояние (вода).
Области III, II I отделены так называемыми пограничными линиями: левой АК иправой KD. Общая для левой и правой пограничных линий (и областей III, II I)точка K обладает особыми свойствами и называется критической точкой. Эта точка имеет определенные параметры pкр, vкриTкр, при которых кипящая вода переходит в перегретый пар, минуя двухфазную область. Отсюда следует, что вода (точнее ее жидкая фаза) не может существовать при температурах выше Tкр. Будучи нагретым до этой температуры, весь объем воды практически мгновенно должен превратиться в пар. Вместе с тем пар при давлениях, больших, чем ркр, и при охлаждении до температуры Ткр непосредственно превращается в жидкость, минуя область влажного пара. Критическая точка воды имеет следующие параметры: ркр = 22,136 МПа; tKp = 374,15 °С; vKp - 0,00326 м3/кг.
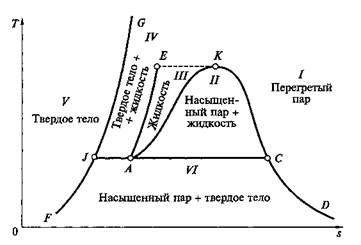
Рис. 2.8. Фазовая диаграмма для воды и водяного пара в координатах Т, s
Значения р, t, v и s для обеих пограничных линий (кипения и сухого насыщенного пара) приводятся в специальных таблицах термодинамических свойств водяного пара.
На современных крупных тепловых электростанциях основным двигателем является паровая турбина, где в качестве рабочего тела используется водяной пар, который получают в паровых котлах. Процесс парообразования в котлах обычно происходит при постоянном давлении, т. е. р = const.
Процессы нагрева воды до кипения, парообразования и перегрева водяного пара на p–v и Т–s-диаграммах изображены на рис. 2.9.
Для обозначения величин, относящихся к различным состояниям воды и пара, устанавливается следующая индексация:
индекс 0 означает, что величина относится к начальному состоянию воды;
индекс ' – к воде, нагретой до температуры кипения;
индекс " – к сухому насыщенному пару;
индекс х – к влажному насыщенному пару;
без индекса — относится к перегретому пару.
Рассматривая процесс парообразования при более высоком давлении р1> р0можно отметить, что точка а, соответствующая состоянию жидкой воды при температуре 0°С и новом давлении, остается практически на той же вертикали, так как удельный объем воды почти не зависит от давления. Точка b’ соответствующая состоянию воды при температуре кипения, смещается вправо (на р–v-диаграмме) и поднимается вверх (на T–s-диаграмме), так как с увеличением давления увеличивается температура кипения и, следовательно, удельный объем воды. Точка с', соответствующая состоянию сухого насыщенного пара, смещается влево, так как с увеличением давления удельный объем пара уменьшается несмотря на увеличение температуры.
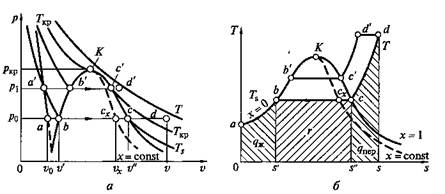
Рис. 2.9. р–v-диаграмма (а)и Т– s-диаграмма (б) для воды и водяного пара
Соединение множества точек b и спри различных давлениях дает нижнюю и верхнюю пограничные кривые аК и Кс. Из p—v-диаграммы видно, что по мере увеличения давления разность удельных объемов v' и v" уменьшается и при некотором давлении становится равной нулю. В этой точке, называемой критической, сходятся пограничные кривые а К и Кс. Состояние, соответствующее точке К, называется критическим. Оно характеризуется тем, что при нем пар и вода имеют одинаковые удельные объемы и не отличаются по свойствам друг от друга.
Заметим, что на Т–s-диаграмме площадь Oabs', соответствует количеству теплоты, требующемуся для нагрева жидкой воды до температуры кипения. Количество подведенной теплоты, равное теплоте парообразования г, Дж/кг, выражается площадью s'bcs" и определяется уравнением
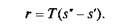
Количеству подведенной теплоты в процессе перегрева водяного пара соответствует площадь s"cds.
На Т–s-диаграмме видно, что по мере увеличения давления теплота парообразования уменьшается и в критической точке становится равной нулю.
Обычно Т–s-диаграмма применяется при теоретических исследованиях, так как практическое использование ее сильно затрудняется тем, что количество теплоты выражается в ней площадями криволинейных фигур.
i—s- диаграмма водяного пара. Рассмотренная Т–s -диаграмма (см. рис. 2.9, б)дает возможность наглядно представить характер протекания процесса превращения воды в пар различных состояний (влажный, сухой насыщенный и перегретый). Однако при пользовании этой диаграммой устанавливать количества участвующей в процессе теплоты сложно, так как это связано с необходимостью определять по диаграмме соответствующие площади, частично ограниченные кривыми линиями. Поэтому для практических расчетов обычно пользуются i—s- диаграммой водяного пара, по которой это выполнить можно значительно проще. Эта диаграмма (рис. 2.10) представляет собой график, построенный в системе координат i, s, на который нанесены: изобары, изохоры, изотермы, пограничные кривые и линии постоянной степени сухости пара.
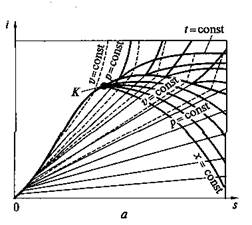
Рис. 2.10. i—s- диаграмма для воды и водяного пара (а)и се практически используемая область для водяного пара (б)
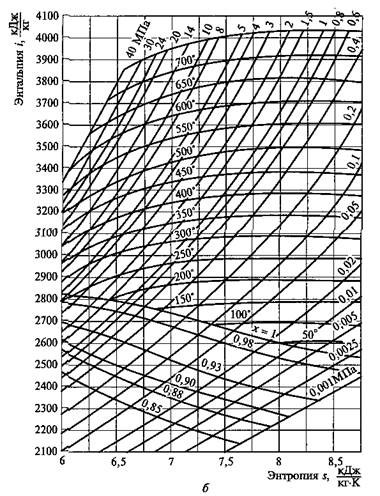

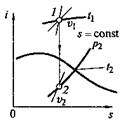
Рис. 2.11. Основные термодинамические процессы водяного пара в координатах i, s
На рис, 2.11 представлены основные термодинамические процессы для водяного пара в координатах i, s.
Достоинством i–s -диаграммы является то, что техническая работа и количество теплоты изображаются на ней отрезками, а не площадями, поэтому она нашла широкое применение в технике,
2.6. Круговой процесс, цикл Карно
Круговой процесс. Ранее было показано, что величины работы и количества теплоты в каком-либо произвольном политропном термодинамическом процессе зависят от характера процесса (показателя политропы); знак работы (положительный или отрицательный) зависит от направления процесса (расширения или сжатия).
Если, например, между точками 1 и 2 (рис. 2.12, а)рабочее тело осуществляет последовательно ряд процессов расширения на пути 1—а—2, а затем также последовательно — ряд процессов сжатия на пути 2—b—1, то в итоге оно совершает так называемый круговой процесс (1–а–2–b–1), или термодинамический цикл, описывающий изменение термодинамических параметров рабочего тела и преобразование теплоты в работу в тепловых машинах.
Непрерывность действия тепловой машины обеспечивается тем, что рабочее тело с параметрами р 1, v 1, Т 1пройдя последовательно ряд процессов расширения на пути 1–а–2 и затем ряд процессов сжатия 2–b–1 с изменением р, v, Т, вновь возвращается в точку 1 (исходное состояние), где p = р 1, v = v 1, T = Т 1и цикл может быть повторен.
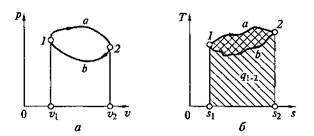
Рис. 2.12. Круговой процесс (цикл): а – на p–v- диаграмме, б – на Т–s- диаграмме
На p–v -диаграмме площадь v 1 –1–а–2–v 2соответствует величине работы расширения:
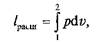
аплощадь контура v 2 –2–b–1–v 1— величине работы сжатия:

причем l расш> l сж.
Так как работа является функцией процесса, а не состояния, то в итоге совершения замкнутого кругового процесса (цикла) в машине непрерывного действия, где l расш> l сж, рабочее тело имеет возможность совершить работу l ц = l расш – l сжэ которой на рис. 2.12, а соответствует площадь внутри контура цикла 1–а–2–b–1.
Так как при процессах расширения к рабочему телу подводилась теплота q расш, то, согласно первому закону термодинамики,
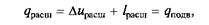
причем на Т–s -диаграмме (рис. 2.12, б)подведенная теплота qnom определяется площадью контура s 1 –1–a–2–s 2, а отведенная теплота q отвпри сжатии – площадью контура s 2 –2–b–l–s 1. При этом q сж = D исж + l сж = qотв, причем q расш> q сж или q под> q отв.
Так как внутренняя энергия является функцией состояния, т. е. величиной, не зависящей от пути процесса, то для любого кругового процесса (цикла)
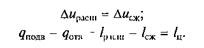
Отсюда следует, что полезная работа цикла /ц должна быть равна разности теплоты, подведенной и отведенной при совершении цикла.
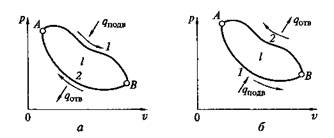
Рис. 2.13. Прямой (а)и обратный (б)циклы на p–v -диаграмме
В цикле, показанном на рис. 2.13, а, линия процесса расширения располагается выше линии процесса сжатия, вследствие чего l расш> l сж и l ц = l расш – l сж. Такие циклы называют прямыми. Очевидно, можно осуществить и другие циклы, в которых процессы сжатия располагаются в р–v- диаграмме выше, чем процессы расширения (рис. 2.13, б). Такие циклы обычно называют обратными, причем для таких циклов l расш< l сж и qnom<q отв, откуда l расш – l сж =:– l ц.
Так как
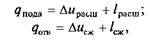
то
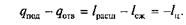
Последние соотношения показывают, что для совершения обратного цикла к рабочему телу должна быть подведена извне работа – l ц, которая в результате совершения цикла превращается в теплоту.
Таким образом, результатом обратного цикла является перенос теплоты от холодного источника к более горячему, что в технике используется для создания холодильных установок.
Термический КПД цикла. Прямые термодинамические циклы, в которых за счет теплоты источника может быть получена полезная работа, отдаваемая внешним потребителям, носят название циклов теплоэнергетических установок. Обратные термодинамические циклы могут применяться либо для отвода теплоты в окружающую среду от рабочего тела, имеющего более низкую температуру (холодильные установки), либо для передачи теплоты от тел с более низкой температурой для нагревания окружающей среды (тепловые насосы).
Задачей прямого цикла является получение работы за счет теплоты источника:
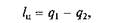
где q 1— теплота от горячего источника; q 2— теплота, отданная холодному источнику.
Оценка совершенства такого никла, составленного из обратимых процессов, производится с помощью так называемого термического (или термодинамического) коэффициента полезного действия h t путем сопоставления полученной работы l ц и подведенной теплоты q 1:
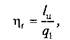
или
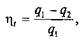
или

Из этих соотношений следует, что термический КПД прямого обратимого цикла определяет, какая часть подведенной в цикле теплоты q 1превращается в работу l ц.
Для обратного цикла холодильных установок критерием эффективности служит холодильный коэффициент

где q2 — теплота, отведенная от холодного источника.
Так как затраченная для осуществления цикла работа l ц = q 1 – q 2, то
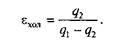
В холодильной установке рабочими телами служат, как правило, пары легкокипящих жидкостей — фреона, аммиака и т. п. Процесс «перекачки теплоты» от тел, помещенных в холодильную камеру, к окружающей среде происходит за счет затрат электроэнергии.
Заметим, что чем меньше разность температур между холодильной камерой и окружающей средой, тем меньше нужно затратить энергии для передачи теплоты от холодного тела к горячему и тем выше холодильный коэффициент.
Холодильную установку можно использовать в качестве теплового насоса. Если, например, для отопления помещения использовать электронагревательные приборы, то количество теплоты, выделенное в них, будет равно расходу электроэнергии. Если же это количество электроэнергии использовать для работы теплового насоса, когда горячим источником, т.е. приемником теплоты qu является отапливаемое помещение, а холодным — наружная атмосфера, то количество теплоты, полученное помещением,
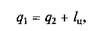
где q 2— количество теплоты, взятое от наружной атмосферы; l ц — расход электроэнергии.
Понятно, что q 1 >l ц, т.е. отопление с помощью теплового насоса выгоднее простого электрообогрева.
На рис. 2.14 показана термодинамическая схема холодильной машины (теплового насоса).
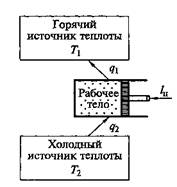
Рис. 2.14. Термодинамическая схема холодильной машины
Цикл Карно. Среди обратимых циклов особое значение имеет цикл, исследованный в 1824 г. французским ученым С. Карно и носящий его имя. Цикл Карно состоит в преобразовании теплоты в работу при наличии только двух источников теплоты: верхнего с температурой Т1 и нижнего с температурой Т 2 < Т 1(рис. 2.15). В прямом цикле Карно рабочее тело от точки 1 расширяется сначала при Тх = const с подводом теплоты qx на участке 1—а, затем в адиабатном процессе до точки 2, охлаждаясь до температуры Т 2 = const, после этого сжимается при Т2= const с отводом теплоты q2 на участке 2-й, а потом по адиабате до восстановления первоначальных параметров в точке 1.
Поскольку в обратимом процессе работа трения отсутствует, то изменения энтропии в адиабатных процессах а–2 (расширение) и b–1 (сжатие) не происходит, следовательно,
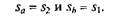
В соответствии с этим подведенная в изотермическом процессе при Т 1= const теплота
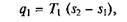
а отведенная теплота
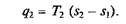
Термический КПД цикла Карно в соответствии с формулой (2.14):
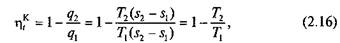
или
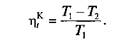
Рис. 2.15. Прямой цикл Карно:
а — на р–v -диаграмме; б — на T–s -диаграмме
Таким образом, в отличие от КПД всех других циклов термический КПД цикла Карно полностью определяется только температурами верхнего и нижнего источников теплоты и возрастает с повышением Т 1 и снижением Т 2. При этом КПД цикла Карно не зависит от рода теплоносителя и от величины полученной за цикл полезной работы.
Цикл Карно обладает также весьма важным свойством, которое позволяет использовать его как эталонный цикл: он имеет наивысший (для данных температур источника и холодильника) термический КПД. Таким образом, можно утверждать, что при данной разности температур Т 1 и Т 2 термический КПД любого обратимого цикла не может быть больше термического КПД обратимого цикла Карно, осуществляемого при тех же температурах Т 1 и Т 2.
Это же утверждение может быть сделано и по отношению к любому обратному обратимому циклу, для температурных условий которого цикл Карно будет иметь наибольшие возможные значения холодильного коэффициента эффективности. При обратных циклах следует иметь в виду, что наиболее эффективным из них будет тот, который для переноса теплоты q2 с температурного уровня Т 2на Т 1потребует подвода извне наименьшей работы, тогда как при прямом цикле эффективность определяется получением максимальной работы l нмах за счет подвода теплоты q 1.
Контрольные вопросы
1.Укажите основные параметры состояния рабочего тела и единицы измерения их.
2. Чем отличается реальный газ от идеального газа?
3.Дайте определение средней и истинной теплоемкости. Чем отличается теплоемкость ср от cv?
4.Объясните сущность первого закона термодинамики и напишите его математическое выражение.
5.Опишите основные термодинамические процессы и укажите энергобаланс этих процессов.
6.Какова сущность второго закона термодинамики? Дайте некоторые формулировки этого закона.
7 что такое цикл Карно? Чем оценивается его эффективность?
8.Покажите на p—v- и Т– s-диаграммах характерные области и линии для воды и водяного пара.
9.Покажите на Т– s-диаграмме площадки, соответствующие теплоте, затрачиваемой на подогрев воды, парообразование и на перегрев пара
10.Чем определяется эффективность холодильной установки?
Внутренняя энергия. Первый закон термодинамики. Энтальпия
Энергиясуществует в различныхвидахи каждый вид энергии является соответствующей формой движения материи.
Внутренняя энергия (U) системы - это одна из важнейших величин в химической термодинамике. Это параметр состояния, термодинамически определяемый на основе первого начала. Физический смысл внутренней энергии заключается в том, что она характеризует общий запас энергии системы. Сюда входят все виды энергии (вращательного и поступательного движения молекул, энергия внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергия вращения электронов в атомах, и т.д.). Но не включает потенциальную энергию положения системы в пространстве и кинетическую энергию движения системы как целого. Внутренняя энергия (U) - функция состояния, - ее значение зависит от начального и конечного состояния системы и не зависит от пути перехода системы из начального состояния в конечное. Абсолютную величину внутренней энергии системы определить пока невозможно и так как неизвестным остается значение Uо (при Т = 0 К), но можно измерить изменение ∆U, происходящее в том или ином процессе. Величина ∆ U считается положительной, когда в рассматриваемом процессе внутренняя энергия системы возрастает.
Пусть некоторая система за счет поглощенной теплоты (Q) переходит из одного состояния в другое. В общем случае эта теплота затрачивается на изменение внутренней энергии системы ∆ U = U2 – U1и на совершение работы против сил внешнего воздействия А, то есть Q = ∆U + A. Это уравнение - математическое выражение первого закона (первое начало) термодинамики (закон сохранения энергии).
Первый закон термодинамики непосредственно связан с законом сохранения энергии, который устанавливает эквивалентность различных её форм: различные формы энергии переходят друг в друга в строго эквивалентных, всегда одинаковых соотношениях. Отсюда вытекает, что в любой изолированной системе общий запас энергии остается постоянным.
Для процессов с бесконечно малыми изменениями dQ = dU + dA,
где dU - функция состояния (полный дифференциал), dQ и dА - функции процесса, то есть зависят от способа совершения (осуществления) процесса и выражают бесконечно малые количества теплоты и работы.
Из этого соотношения вытекает ряд следствий:
1. Для кругового процесса в котором ∆U = U2 – U1 = 0, соблюдается равенство
Q = A; (dQ = dA)
2. Для изотермического (изотермного) процесса, в котором работа совершается против внешнего давления dA = pdV, имеем
dQ = dU + pdV или Q = ∆U + p∆V
3. Для изохорных процессов, где не происходит изменения объема, то есть
∆V = 0 или dV = 0, и работа А = 0, переходу системы из одного состояния в другое отвечает равенство
Q = U2 – U1 = ∆U, или dQ = dU
4. Для изобарных процессов, при Р = соnst:
Q = (U2-U1) + p(V2-V1) = (U2 + pV2) – (U1 + pV1);
приращение функции U + рV обозначим Н, Q = H2 – H1 = ∆H, где Н - энтальпия, или
dQ = dН.
Энтальпию часто называют теплосодержанием системы, но это не количество теплоты в теле. Ее изменение, как и изменение внутренней энергии системы, не зависит от пути процесса, так как изменение объема при постоянном давлении определяется только начальным и конечным состоянием системы. Разница между внутренней энергией U и энтальпией Н относительно невелика для конденсированных состояний и для веществ в кристаллическом состоянии не превышает ≈ 5 %. Но разница значительна для систем, содержащих вещества в газообразном состоянии.
Изменение энтальпии может иметь положительное и отрицательное значение. Положительное значение, ∆H > 0 соответствует эндотермическому процессу, то есть процессу, идущему с поглощением теплоты, а отрицательное значение, ∆H < 0 - экзотермическому, то есть процессу, идущему с выделением теплоты (рис. 35). Энергия передается от одной части системы к другой в форме теплоты или в форме работы. Теплота не является функцией состояния, то есть количество теплоты, выделяемой или поглощаемой системой при переходе из одного состояния в другое, зависит от пути перехода. Но для изохорных и изобарных процессов, теплота превращается в функцию состояния.
Тепловым эффектом процесса называют сумму поглощаемой теплоты и всей работы, выполняемой окружающей средой над данной системой, за вычетом работы внешнего давления. Для изохорно-изотермических процессов тепловой эффект равен изменению внутренней энергии системы ∆U = U2 – U1, а для изобарно-изотермических - изменению энтальпии ∆H = H2 – H1.
Таким образом, при постоянной температуре в изохорных и в изобарных процессах тепловой эффект не зависит от пути перехода и однозначно определяется начальным и конечным состояниями системы.
Основные понятия термодинамики– 1-е начало термодинамики – Закон Гесса – Закон Кирхгофа
Первое начало термодинамики является постулатом – оно не может быть доказано логическим путем или выведено из каких-либо более общих положений. Истинность этого постулата подтверждается тем, что ни одно из его следствий не находится в противоречии с опытом. Первое начало термодинамики устанавливает соотношение между теплотой Q, работой А и изменением внутренней энергии системы ΔU.
Эквивалентность теплоты и работы
Постоянное эквивалентное соотношение между теплотой и работой при их взаимных переходах установлено в классических опытах Джоуля. Типичный эксперимент Джоуля заключался в следующем: падающий с известной высоты груз вращает мешалку, погружённую в воду, находящуюся в калориметре (груз, мешалка и калориметр с водой составляет термодинамическую систему); при этом совершается работа силы тяжести А = mgh. Вращение лопастей мешалки в воде вызывает нагревание воды в калориметре; теплота, переданная воде, равна произведению теплоёмкости калориметра с водой на произошедшее изменение температуры: Q = cΔt. После того, как указанный процесс закончен, система должна быть приведена к исходному состоянию. Это можно сделать путём мысленного эксперимента. Груз поднимается на исходную высоту, при этом извне над системой совершается работа, которая увеличивает энергию системы. Кроме того, от калориметра при охлаждении его до исходной температуры отнимается (передаётся в окружающую среду) теплота. Эти операции возвращают систему к исходному состоянию: все измеримые свойства системы приобретают те же значения, которые они имели в исходном состоянии. Процесс, в течение которого система изменяла свои свойства и в конце которого вернулась к исходному состоянию, называется круговым (циклическим) процессом или просто циклом.
Единственным результатом описанного цикла является отнятие работы от среды, окружающей систему, и переход в эту среду теплоты, взятой у калориметра. Сравнение двух величин (работы и теплоты) показывает постоянное отношение между ними, не зависящее от величины груза, размеров калориметра и конкретных количеств теплоты и работы в разных опытах.
Теплоту и работу в циклическом процессе целесообразно записать как интегральную сумму бесконечно малых (элементарных) теплотδQ и бесконечно малых (элементарных) работ δА,
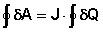 (1)
(1)
Здесь J - коэффициент пропорциональности, называемый механическим эквивалентом теплоты; его можно принять равным единице, выразив теплоту и работу в одних и тех же единицах измерения. Уравнение (1) представляет собой закон сохранения энергии для частного случая превращения работы в теплоту.
Рассмотрим следующий цикл: система переходит из состояния I в состояние II по некоторому пути 1; при этом передается теплота Q1 и совершается работа А1. Затем система возвращается в исходное состояние, причем обратный переход может совершаться как по тому же пути, что и прямой, т.е. за счет передачи теплоты –Q1 и совершения работы –А1, так и любым другим путем – за счет передачи теплоты Q2 и совершения работы А2, передачи теплоты Q3 и совершения работы А3 и т.д.
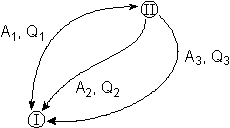
Для любого пути мы можем записать:
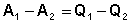 ,
, 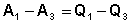 , …
, … 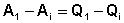 (2)
(2)
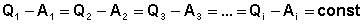 (3)
(3)
Величина "const" характеризует свойства системы; эта разность зависит только от начального и конечного состояния системы и не зависит от того, каким путём система переходит из начального состояния в конечное. Эту константу можно представить как изменение некоторой функции состояния (свойства системы, не зависящего от пути перехода системы из одного состояния в другое), называемой внутренней энергией системы U. Тогда
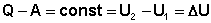 (4)
(4)
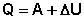 (5)
(5)
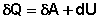 (6)
(6)
Уравнения (4-5) являются математической записью 1-го начала термодинамики для конечного, уравнение (6) – для бесконечно малого изменения состояния системы. Теперь можно сформулировать первое начало термодинамики следующим образом:
Теплота, подведённая к системе, расходуется на совершение системой работы против внешних сил и на изменение внутренней энергии системы.
Изменение внутренней энергии системы равно количеству сообщенной системе теплоты минус количество работы, совершенной системой против внешних сил.
Уравнения (4-5) являются математической записью 1-го начала термодинамики. Выражение (4) можно переписать следующим образом:
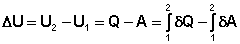 (7)
(7)
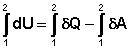 (8)
(8)
В этом случае из уравнения (1) следует:
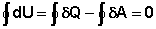 (9)
(9)
Отсюда следует вывод, что в циклическом процессе внутренняя энергия системы не изменяется. Предположим, что данное условие не выполняется. Тогда, очевидно, циклический процесс можно провести таким образом, что после того, как система вернулась к исходному состоянию, внутренняя энергия системы не приняла начального значения, а увеличилась. В этом случае повторение круговых процессов вызвало бы накопление энергии в системе. Создалась бы возможность превращения этой энергии в работу и получения таким путём работы не за счет теплоты, а "из ничего", т.к. в круговом (циклическом) процессе работа и теплота эквивалентны друг другу, что показано прямыми опытами.
Исходя из вышеизложенного, можно сформулировать первое начало термодинамики также следующим образом:
Невозможно построить вечный двигатель 1-го рода, совершающий работу без затраты эквивалентного количества другого вида энергии
Полный запас внутренней энергии системы в результате цикличес
 2017-12-14
2017-12-14 1959
1959