ХІХ ғасырдың аяғында швед ғалымы Сванте Аррениус электролиттік диссоциация теориясын ұсынды.
Судағы ерітiндiлерi немесе балқымалары иондарға ыдырайтын және электр тоғын өткiзетiн заттарды электролиттер деп атайды.
Иондарға толық ыдырайтын электролиттердi күштi электролиттер деп, жартылай ыдырайтын электролиттердi орташа немесе әлсiз электролиттер деп атайды.
Күштi электролиттер ерітiндiлерiнде тек иондар болады, молекулалар болмайды.
Әлсiз электролиттердiң ерітiндiсiнде иондармен бiрге молекулалар да болады.
H2SO4 «H++HSO4-
HSO4- «H++SO42-
Ва(OH)2 «ВаOH++OH-
ВаOH+ «Ва2++OH-
Электролит күшiн ток өткiзгiштiгiне қарап анықтайды: 
lv – заттың берілген сұйылту кезіндегі эквиваленттік электрөткізгіштігі;
l¥ - заттың шексіз сұйылту (V®¥) кезіндегі электрөткізгіштігі.
Диссоциациялану дәрежесі: 
n- иондарға ыдыраған молекулалар саны;
N- жалпы ерітілген молекулалар саны.
a-ны сандық үлеспен немесе пайызбен көрсетуге болады. Шексіз cұйылту кезінде a=1 немесе 100% болады.
Егер алынған 100 молекуланың 80-ні иондарға ыдыраса, онда бұл электролиттің диссоциациялану дәрежесі 80% болғаны.
Әлсіз электролиттердің тепе-теңдік константасы Кт-т н/се диссоциациялану константасы Кд:
Н2СО3 «Н++НСО3-1 (1 сатысы).

HCO3- «H++CO3-2
 (2 сатысы)
(2 сатысы)
Кд неғұрлым аз болса, электролит соғұрлым әлсіз болады.
Тұнбаға түсетін электролиттер, яғни аз еритін қосылыстар үшін басқа өлшем бірлігі қолданылады, ол ерігіштік көбейтіндісі ЕК деп аталады, мысалы:
AgCl¯ «Ag++Cl-

ЕК=[Ag+]·[Cl-]. «ЕК» және «Кд» кесетеде беріледі.
Күшті электролит ерітіндісіндегі күйін, нақты әрекетін, соған сәйкес ерітіндінің қасиеттеріне әсерін анықтау үшін иондардың активтік концентрациясы қолданылады:  аион =сион. fион
аион =сион. fион
аион –ионның активтілігі;
сион - ион концентрациясы;
fион - активтілік коэффициенті.
Активтілік коэффициенті ерітіндінің иондық күшімен де анықталады. Ол Дебай-Гюккель формуласымен беріледі.

 J1/2
J1/2
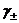 -ионның орташа активтілік коэффициенті;
-ионның орташа активтілік коэффициенті;
 -катион, анион заряды;
-катион, анион заряды;
J –ерітіндінің иондық күші.
Қайтымсыз реакциялардың бірнеше жағдайлары бар.
1. Әлсіз электролит – су түзілуі, бейтараптану реакциялары:
2NaOH+H2SO4 = Na2SO4+2H2O
2Na++2OH-+2H++SO4-2 = 2Na++SO4-2+2H2O. Кд=1,8×10-16
2OH-+2H+ = 2H2O
2. Әлсіз қышқылды күшті қышқылмен ығыстыру:
K2CO3+2HCl = 2KCl+H2CO3. Кд =4,5×10-7
2K++CO3-2+2H++2Cl- = 2K++2Cl-+H2CO3
CO3-2+2H+ = H2CO3-
3. Әлсіз негізді күшті негізбен ығыстыру:
CuSO4+2KOH = Cu(OH)2¯+K2SO4
Cu+2+SO4-2+2K++2OH- = Cu(OH)2¯+2K++SO4-2
ЕК =2,2×10-20
Cu+2+2OH- = Cu(OH)2¯
4. Реакциядан шығып кететін газ күйіндегі заттардың түзілуі:
(NH4)2S+2HBr = 2NH4Br +H2S(г). Кд1=8,9×10-8
2NH4++S-2+2H++2Br- = 2NH4++2Br- +H2S
S-2+2H+ = H2S
5. Қиын еритін тұз тұнбаларының түзілуі:
BaCl2+Na2SO4 = BaSO4¯+2NaCl
ЕК = 1,1×10-10
Ba+2+2Cl-+2Na++SO4-2 = BaSO4¯+2Na++2Cl-
Ba+2+SO4-2 = BaSO4 ¯
$$$ 61
Электролиттік диссоциация дегеніміз:
А) бөлек атомдарға электролиттің бөліну процесі;
В) иондар мен атомдар түзілу процесі;
С) иондардың молекулаларға қосылу процесі;
D) заттың бөлек молекулаларға өзіндік ыдырауы;
Е) балқу немесе суда еріту кезінде заттардың иондарға ыдырау процесі.
Е) байланыс энергиясы.
$$$ 84
Ион алмасу реакция аяғына дейін өтеді егер... әрекеттессе.
А) AI(NO3)3 және KCI;
B) CuSO4 және Zn(NO3)2;
C) NaCI және LiNO3;
D) HCI және Na2CO3;
E) KOH және NaOH.
$$$ 237
Mg(OH)2 үшін иондық көбейтіндісі неге тең?
A) [Mg2+]×[OH-];
B) [Mg2+]2×[OH-];
C) [Mg2+]×[OH-]2;
D) [Mg2+]+[OH-];
E) [Mg2+]+[OH-]2.
$$$ 90
6,8 г күкіртсутектің көлемін анықтаңыз (қ.ж.).
А) 1,2 л;
В) 2,4 л;
С) 3,2л;
D) 5,6л;
Е) 4,48л.
$$$ 96
0,25н NaOH ерiтiндiсiнiң титрiн (г/мл) анықтаңыз.
А) 0,01;
В) 0,02;
С) 0,03;
D) 0,5;
Е) 1,0.
$$$ 97
Әлсiз электролиттi көрсетiңiз:
А) HNO3;
В) NaOH;
С) Al(OH)3;
D) Na2SO4;
Е) KCl.
$$$ 98
Құрамында 8 г затпен 100 г диэтил эфир бар ерітінді 36,860С-да, ал таза эфир 35,600С-да қайнайды. Еріген заттың молекулалық массасын анықтаңыз. Е(эфир)=2,020.
А) 128,2 г/моль;
В) 345 г/моль;
С) 67 г/моль;
D) 57,9 г/моль;
Е) 158 г/моль.
$$$ 99
Натрий ортофосфаты толық диссоциацияланғанда түзiлетiн ион саны:
А) 2;
В) 3;
С) 4;
D) 6;
Е) 5.
ТҰЗ ГИДРОЛИЗІ. СУТЕКТІК КӨРСЕТКІШ
Су - әлсіз электролит, Кд - 1,8∙10-16
Н2О «Н++ОН-

1л су алайық. 250С судың тығыздығы 1г/см3. Сондықтан 1л Н2О массасы 1000г: m=d×V=1г/см3×1000см3=1000г.
Мольдік концентрация,  .
.
Формулаға (1) n мәнін қоямыз. Сонда:
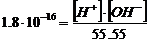 (2)
(2)
Осыдан тұрақтыларды көбейтіп,
[Н+][ОН-]=1,8×10-16×55,55=1,0×10-14 аламыз.
[Н+][ОН-]=1,0×10-14 - судың иондық көбейтіндісі.
[Н+]=[ОН-]=Ö1,0×10-14 = 1,0×10-7 болғандықтан,
[Н+]=[ОН-]=1,0×10-7 - бейтарап реакция болады.
Егер [Н+]>[ОН-] болса, ортаның реакциясы - қышқылдық болады.
Егер [Н+]<[ОН-] болса, ортаның реакциясы - сілтілік болады.
Судың иондық көбейтіндісіне байланысты реакция 10-1 ден 10-14-ке дейін өзгеруі мүмкін.

 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14
10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14

 қышқылдық бейтарап сілтілік
қышқылдық бейтарап сілтілік
Көрсеткіш дәрежесі теріс санды қолдану ыңғайсыз болғандықтан, сутегі иондарының концентрациясын рН символымен белгілеп – рН арқылы өрнектеу қабылданған.
Сутектік көрсеткіш (рН) – теріс таңбамен алынған сутегі иондарының концентрациясының ондық логарифмін айтады:
рН= -lg[Н+]
Мысалы: [Н+]=10-4, болғанда рН= -lg[Н+] = -lg[10-4] = 4.
Есеп: рН=5 болғандағы [ОН-] табыңыз.
1) [Н+] [ОН-]=10-14. РН=5; [Н+]=10-5

2) рН+рОН = 14
рОН = 14-5 = 9; [ОН-] = 10-9
Сутектік көрсеткіш түсінігін 1909ж. дат химигі Соренсен енгізді.
Тұздардың гидролизі
Тұздардың еріген бөлшектерінің су иондарымен әрекеттесіп, нәтижесінде жаңа әлсіз электролиттер түзілетін және рН орта өзгеретін реакцияны тұздардың гидролизі деп атайды. Тұз құрамына байланысты гидролиз бірнеше схемада жүреді.
1) Күшті қышқыл мен күшті негізден түзілген тұз гидролизі:
KNO3+HOH=KOH+HNO3
K++NO3- +HOH=K++OH-+H++NO3-
HOH=OH-+H+=HOH pH = 7 бейт.орта; гидролиз процесс жүрмейді.
Күшті катион мен анионнан түзілген тұз гидролизденбейді.
2) Күшті қышқыл мен әлсіз негізден түзілген тұз гидролизі:
NH4Cl+HOH=NH4OH+HCl
NH4++Cl-+HOH=NH4OH+H++Cl-
NH4++HOH=NH4OH+H+. pH<7 қыш.орта
Егер әлсіз катион екі-үш зарядты болса, онда аралығында негіздік тұз түзіледі, гидролиз сатылап жүреді.
СuCl2+HOH=CuOHCl+HCl.
Cu+2+2Cl-+HOH=CuOH++Cl-+H++Cl-
Cu+2+HOH=CuOH++H+. pH<7.
Әлсіз катион аралық гидроксокатион түзеді.
3) Күшті негіз бен әлсіз қышқылдан түзілген тұз гидролизі:
 K2CO3+HOH=KOH+KHCO3
K2CO3+HOH=KOH+KHCO3
2K++CO3-2+HOH=K++OH-+K++HCO3-. Kд1=7,5×10-7
CO3-2+HOH=OH- +HCO3- Kд2=7,8×10-11 pH>7 нег.орта
Гидроанион түзіледі.
4) Әлсіз негіз бен әлсіз қышқылдан түзілген тұз гидролизі:
NH4CN+HOH ↔ NH4OH + HCN
1,8×10-5 4,9×10-13
NH4++CN-+HOH=NH4OH+HCN. pH»7
Екі әлсіз электролит түзілгендіктен, ортаның реакциясы бейтарап.
5) Екі тұздың бірігіп гидролизденуі, егер олардың реакциялық заттары сулы ортада болмаса еру кестесінде сызықша тұр.
2AlCl3+3Na2CO3+6HOH=2Al(OH)3+3H2CO3+6NaCl.
Яғни, алюминий карбонаты түзілмейді, ол тез бір сатыда гидролизденеді де, әлсіз электролиттер түзеді.
2Al+3+6Cl-+6Na++3CO3-2 +6HOH=2Al(OH)3¯+3H2O+3CO2 + 6Na++6Cl
2Al+3+3CO3-2 +3HOH=2Al(OH)3¯+3CO2 . pH»7.
Тұз гидролизінің сандық сипатын гидролиздің көрсеткіші береді:
 гидр =
гидр = 


Сгидр - гидролизденген тұздың моль саны;
Сжалпы – еріген тұз молінің жалпы саны.
Тұз гидролизін, сонымен қатар гидролиздену реакцияның тепе-теңдік константасын белгілейтін гидролиз константасы Кгидр. анықтайды.
Күшті негіз бен әлсіз қышқылдан түзілген (гидролиз анион бойынша) тұз гидролизінің константасы судың иондық көбейтіндісінің гидролиз кезінде пайда болатын әлсіз қышқылдың диссоциация константасының қатынасына тең: Кгидр =КН2О / Кн
$$$ 244
рН ерітіндінің дұрыс өрнегін көрсетіңіз:
А) pH = -lg[H2O];
B) pH = -lg[H+];
C) pH = pOH;
D) pH =-ln[H+];
E) pH = lg[H+].
$$$ 100
Берiлген заттардың қайсысы гидролизiнде қышқыл тұз түзiледi?
А) KNO3;
В) CuSO4;
С) NiCl2;
D) K2S;
Е) Na2SO4.
$$$ 91
0,01 М HNO3 ерітіндісінің рОН мәнін есептеңіз.
А) 10;
В) 12;
С) 8;
D) 2;
Е) 6.
$$$ 92
0,01 М КОН ерітіндісінің рН мәнін есептеңіз.
А) 2;
В) 6;
С) 8;
D) 10;
Е) 12.
$$$ 93
Ерiтiндiсінің ортасы сiлтiлiк болатын тұзды анықтаңыз.
А) K2SO4;
В) K2CO3;
С) MgSO4;
D) CuCl2;
Е) NaNO3.
$$$ 94
Гидролизге ұшырамайтын тұзды анықтаңыз.
А) KNO3;
В) K2S;
С) MgSO4;
D) AlCl3;
Е) Na2CO3.
$$$ 95
Қай тұз гидролизге түскенде негiздiк тұз түзіледi?
А) CsCl;
В) Ba(NO3)2;
С) FeCl3;
D) K2S;
Е) Na2CO3.
$$$ 103
Қайсы тұз ерiтiндiсi гидролизденгенде сiлтiлiк орта (рН>7) болады?
А) CuSO4+HOH®¼
В) MgCl2+HOH®¼
С) KNO3+HOH®¼
D) CH3COONa+HOH®¼
Е) Na2SO4+HOH®¼
$$$ 105
Қайсы тұздың гидролизі үш сатыдан өтедi?
А) CrCl3;
В) (NH4)2SO4;
С) NaCN;
D) K2S;
Е) Zn(NO3)2.
$$$ 106
Қайсы тұз ерiтiндiсi гидролизденгенде қышқыл орта (рН<7) болады?
А) Na2CO3;
В) K2SO4;
С) CuCl2;
D) NaCl;
Е) FeS.
$$$ 239
Судың иондық көбейтіндісі неге тең?
А) 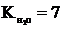 ;
;
В)  ;
;
С)  ;
;
D) 
Е) 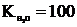 .
.
$$$ 234
Тұздың қайсы гидролизденеді?
А) (NH4 )2S;
B) K2SO4;
C) NaCI;
D) NaNO3;
Е) KCI.
$$$ 235
Ерітіндінің рН мәнін есептеңіз, егер Н+ иондардың концентрациясы 10-4 моль/л тең болса?
А) 12;
В) 10;
С) 7;
D) 4;
Е) 3.
$$$ 107
Ерiтіндiнiң рОН-ы 3-ке тең болса, сутек иондарының концентрациясы неге тең?
А) 10-3;
В) 10-5;
С) 10-7;
D) 10-9;
Е) 10-11.
$$$ 110
Тұздар бiрлесе гидролизденгенде қандай газ бөлініп шығады: AlCl3+Na2CO3+HOH®…
А) Cl2;
В) H2;
С) CO;
D) O2;
Е) CO2.
$$$ 111
Қайсы тұз ерiтiндiсiнде рН мәнi жоғары болады?
А) K2CO3;
В) Al(NO3)3;
С) FeCl3;
D) Cu(CH3COO)2;
Е) ZnSO4.
$$$ 113
Көлемi 11,2 л азоттың массасы неге тең (қ.ж.):
А) 28 г;
В) 280 г;
С) 14 г;
D) 140 г;
Е) 30 г.
$$$ 114
Қорғасын хлоридінің ЕК-ң математикалық өрнегі қайсы?
А)  = [Pb2+]×[Cl-]2;
= [Pb2+]×[Cl-]2;
В)  = [Pb2+]× [2Cl-];
= [Pb2+]× [2Cl-];
С)  = [Pb+]×[Cl-];
= [Pb+]×[Cl-];
D)  = [Pb+]2×[Cl-]2;
= [Pb+]2×[Cl-]2;
Е)  = [Pb2+]×[ Cl-].
= [Pb2+]×[ Cl-].
$$$ 121
рН 6-ға тең ерiтiндiдегi сутек иондарының концентрациясы неге тең (моль/л)?
А) 10-5;
В) 10-6;
С) 10-7;
D) 10-8;
Е) 10-1.
$$$ 122
Құрамында 16 г сахароза (С12Н22О11) мен 350 г суы бар ерітіндінің 293К-дегі осмос қысымы неге тең? Ерітіндінің тығыздығы 1-ге тең деп есепке алыңыз.
А) 789кПа;
В) 312кПа;
С) 24кПа;
D) 567кПа;
Е) 123кПа.
$$$ 123
Көлемі 200 мл ерітіндідегі сахарозаның (С12Н22О11) массасы қандай, егер 00С-да оның осмос қысымының мәні 6,61×105 Па тең болса.
А) 169,7г;
В) 19,93г;
С) 12,34г;
D) 23,45г;
Е) 34,56г.
$$$ 128
Ерiтiндiнiң рН бiр мәнге өсу үшiн ерiтiндiдегi сутек иондарының концентрациясын қалай өзгерту қажет?
А) 10 есе арттыру керек;
В) 2 есе арттыру керек;
С) 1 моль/л-ға арттыру керек;
D) 10 есе кеміту керек;
Е) 1 моль/л-ге кеміту керек.
$$$ 129
Қайсы электролит ерiтiндiсiнде хлорид ион бар екенін анықтауға болады?
А) NaClO;
В) NaCl;
С) NaClO3;
D) NaClO2;
Е) NaClO4.
$$$ 130
Қайсы электролит диссоциацияланғанда гидроксокатион түзiледi?
А) CuSO4;
В) NaHCO3;
С) Al(Ac)3;
D) CuOHCl;
Е) NaH2PO4.
$$$ 131
Қайсы электролит диссоциацияланғанда гидроанион түзiледi?
А) AlOHCl2;
В) Na2SO4;
С) NH4OH;
D) (CuOH)2SO4;
Е) Na2HPO4.
$$$ 134
Қайсы түз гидролизденбейдi?
А) K2CO3;
В) NH4Cl;
С) Na2SO4;
D) (NH4)2S;
Е) FeCl3.
$$$ 135
Қайсы түз ерiтiндiсiнiң гидролизiнде реакция ортасы нейтралды болады, яғни рН=7?
А) NaHCO3;
В) NH4CN;
С) Cu(NO3)2;
D) K2S;
Е) AlCl3.
$$$ 136
Электролит затты көрсетіңіз.
А) Cu;
В) CuO;
С) O2;
D) CuSO4;
Е) NO.
$$$ 138
Бiрдей жағдайдағы Н+ ионының концентрациясын ең аз беретін қышқылды көрсетіңіз:
А) HClO2 Kд=1×10-2;
В) HClO Kд=2,95×10-8;
С) HClO3 Kд=1×103;
D) HClO4 Kд=1×108;
Е) HCl Kд=1×108,9.
$$$ 139
Күшті электролитті көрсетіңіз.
А) HNO3 a=94 %;
В) СН3СОOH a= 2 %;
С) НCN a=0,15 %;
D) NH4OH a=1,35 %;
Е) H2CO3 a=0,17 %.
$$$ 140
Қайсы электролит сатылап диссоциацияланады?
А) KCN;
В) H2SO3;
С) NaOH;
D) KNO3;
Е) HCl.
$$$ 141
Қайсы реакция ерімейтін қосылыс түзе жүреді?
А) Ni(OH)2+HNO3®…
В) CaCO3+HCl®…
С) Zn(OH)2+NaOH®…
D) FeCl3+NaOH®…
Е) H2SO4+KOH®…
$$$ 142
Қай реакцияның қысқаша иондық теңдеуі Н++ОН-=Н2О қола алады?
А) CH3COOH+Ca(OH)2®…
В) H2CO3+KOH®…
С) HNO3+NaOH®…
D) H2SO4+Cu(OH)2®…
Е) HCl+NH4OH®…
$$$ 143
Қай реакция газ заттың түзілуімен жүреді?
А) CaCO3+HCl®…
В) Na2SiO3+HCl®…
С) Na2SO4+BaCl2®…
D) NH4Cl+AgNO3®…
Е) H2CO3+Ca(OH)2®…
$$$ 147
Мыс(ІІ) сульфатының 3,01×1023 молекула санының массасын есептеңіздер.
А) 40г;
В) 80г;
С) 50г;
D) 100г;
Е) 1г.
$$$ 149
ОН--гидроксид-иондарының тотығу нәтижесiнде анодта қандай газ бөлiнедi?
А) О2;
В) Н2;
С) О2-;
D) ОН-;
Е) Н2О.
$$$ 150
Қайсы металдың бетiнде қорғағыш оксидтiк пленка түзiледi?
А) Al;
В) Ca;
С) K;
D) Fe;
Е) Na.
$$$ 151
20%-тік ерітіндіні алу үшін, еріген заттың массалық үлесі 10 және 40% тең екі ерітіндіні қандай массалық қатынаста араластыру керек?
А) 2:3;
B) 5:7;
C) 2:1;
D) 1:3;
Е) 3:4.
$$$ 152
1,5 сағат бойы күкірт қышқылының сулы ерітіндісінен күші 6 А ток өткізілді. Ыдыраған судың массасын есептеу керек.
А) 3,02г;
В) 0,09г;
С) 10г;
D) 79,9г;
Е) 100г.
$$$ 153
Металдардың атомдары кристалды күйде... байланысқан.
А) сутектік байланыспен;
В) металдық байланыспен;
С) иондық байланыспен;
D) коваленттік байланыспен;
Е) донорлы-акцепторлық байланыспен.
$$$ 154
Қай қатарда тек амфотерлі гидроксидтер жазылған?
А) Mn(OH)2, Cu(OH)2, Mg(OH)2;
В) Be(OH)2, Zn(OH)2, Cr(OH)3;
С) Co(OH)3, Fe(OH)3, Al(OH)3;
D) KOH, NH4OH, LiOH;
Е) NaOH, AgOH, AuOH.
$$$ 155
Негізгі тұздың түзілуіне қай теңдеу сәйкес келеді?
А) Zn(OH)2+HNO3®¼
В) KOH+H2SO4®¼
С) NH4OH+H2S®¼
D) NaOH+HCN®¼
Е) LiOH+H3PO4®¼
$$$ 156
Қышқыл тұздың түзілуіне қай теңдеу сәйкес келеді?
А) KOH+HNO3®¼
В) HCl+Fe(OH)3®¼
С) Cr(OH)3+CH3COOH®¼
D) NaOH+H2SO3®¼
Е) Ca(OH)2+HCl®¼
$$$ 157
Су түзілуімен NaOH пен әрекеттесетін затты көрсетіңіз:
А) K2SO4;
В) HCl;
С) Ba(OH)2;
D) KNO3;
Е) KOH.
$$$ 158
Натрий гидроксидымен әрекеттесетін затты көрсетіңіз:
А) K2O;
В) SO3;
С) CaO;
D) BaO;
Е) Li2O.
$$$ 159
Берилий гидроксиды түзілетін реакцияны көрсетіңіз:
А) BeCl2+AgNO3®¼
В) BeO+H2SO4®¼
С) Be(NO3)2+Ca(OH)2®¼
D) BeSO4+BaCl2®¼
Е) BeCO3+HCl®¼
$$$ 160
Келтірілген тұздардың қайсысы негізгі?
А) K2SO4;
В) BaCl2;
С) NaHCO3;
D) Al2(SO4)3;
Е) MgOHCl.
$$$ 161
Қай қатарда оксидтердің негізгі сипаты артады:
А) As2O3®BiO3®Sb2O3;
В) CaO®CrO®CuO;
С) CaO®SrO®BaO;
D) Cs2O®BaO®CdO;
Е) MnO®MnO3®Mn2O7.
$$$ 162
Оксидтердің қайсысы сумен әрекеттескенде қышқыл түзеді?
А) SO2;
В) FeO;
С) MnO;
D) K2O;
Е) Co2O3.
$$$ 163
Оксидтердің қайсысы суда негіз түзілуімен ериді?
А) SiO2;
В) Na2O;
С) MoO3;
D) Cl2O3;
Е) P2O5.
$$$ 164
Тұздардың қайсы калий дигидроортофосфат деп аталады?
А) KH2PO3;
В) K2HPO4;
С) K3PO4;
D) KH2PO4;
Е) KPO3.
$$$ 165
(MnOH)2SO3 тұзды атаңыз?
А) марганец гидросульфиті;
В) марганец гидроксиді;
С) марганец сульфиті;
D) марганец сульфаты;
Е) марганец гидроксосульфиті.
$$$ 166
Құрамына азот, сутек және аммиак кіретін газ қоспасының ауа бойынша тығыздығы қандай, егер осы газдардың көлемдік үлесі 30, 10 және 60%-ке сәйкес тең болса?
А) 0,65;
В) 0,32;
С) 0,98;
D) 0,01;
Е) 3,87.
$$$ 167
Әрекеттесудің қайсысы магний гидроксохлоридінен магнийдің қалыпты түздың түзілуіне әкеледі?
А) MgOHNO3+HCl®¼
В) MgOHCl+HCl®¼
С) (MgOH)2SO4+HNO3®¼
D) MgOHCl+NaOH®¼
Е) MgCl2+KOH®¼
Тотығу-тотықсыздану реакциялары -ТТР.
ТТР-электрондардың тотықсыздандырғыштан тотықтырғышқа өтуi нәтижесiнде тотығу дәрежелерi өзгеретiн реакциялар.
Тотығу дәрежесi- молекула құрамындағы атомның жанамадан алған заряды.
Д.И.Менделеев кестесіндегі орнына байланысты элементтердiң тотығу дәрежелерi ең төменгi (-4) дәрежесiнен 8-ге тең дәреже арқылы ең жоғарғы дәрежесiне (+8) дейiн өзгередi.
Менделеев кестесіндегі I, II және III топ элементтерiнiң ион түрiнде тотығу дәрежелерi тұрақты, яғни өзгермейдi. Мысалы: – Н+, Са+2, Аl+3. Барлық басқа топ элементтерiнiң тотығу дәрежелерi тұрақсыз және бiр элементтiң өзi бiрнеше тотығу дәрежелерiн көрсетуi мүмкiн.
Мысалы: марганецтiң төмендегiдей қосылыстары бар:
| Мn0 | Мn+2 | Mn+4 | Mn+6 | Mn+7 |
| MnO | MnO2 | MnO3 | Mn2O7 | |
| Mn(OH)2 | H2MnO4 | HMnO4 |
Тотығу дәрежесi тұрақсыз элемент атомының тотығу дәрежесiн табу үшiн молекула құрамындағы элементтердiң зарядтарының алгебралық қосындысы 0-ге тең деп аламыз. Мысалы:
| H2S | +1×2+X=0 | X=-2 | S-2 |
| H2SO3 | +1×2+X-2×3=0 | Х=6-2=4 | S+4 |
| H2SO4 | 1×2+X-2×4=0 | Х=8-2=+6 | S+6 |
Электрондарды (“е-”) берiп жiберу тотығу процесi, болшек- тотықсыздандырғыш деп аталады. Мысалы:
 Zn0-2e=Zn+2 Zn
Zn0-2e=Zn+2 Zn
S-2-6e=S+4 S-2 тотықсыздандырғыштар
Тотығу процесi кезiнде тотығу дәрежесi өседi.
Электрондарды “е-” қосып алуы тотықсыздану процесi, бөлшек- тотықтырғыш деп аталады Мысалы:
 Mn+7+5e=Mn+2 Mn+7 және Fe+3 – тотықтырғыштар
Mn+7+5e=Mn+2 Mn+7 және Fe+3 – тотықтырғыштар
Fe+3+e=Fe+2
Тотықсыздану процесi кезiнде тотығу дәрежесi төмендейдi.
Галогендер ең жоғарғы (максималды) тотығу дәрежесiн көрсетеді. Олар “е” оңай қосып алады.
Валенттiк электрондарын (1,2,3) оңай берiп жiберетiндер тотықсыздандырғыштар болады. Бұларға сыртқы электрондық деңгейiнде 1,2,3 электрондар бар металдар жатады.
Ең жоғарғы және ең төменгi тотығу дәрежелерiнiң ортасындағы тотығу дәрежесiн көрсететiн иондар екi жақты қасиет көрсетедi, яғни, олар әрi тотықтырғыш, әрi тотықсыздандырғыш бола алады. Мысалы:
Mn+7+5e=Mn+2 тотықтырғыш
S+4-2e=S+6 тотықсыздандырғыш
S-2-2e=S0 тотықсыздандырғыш
S+4+4e=S0 тотықтырғыш
ТТР үш ортада қышқылдық, бейтарап және сiлтiлiк ортада жүруi мүмкiн.
ТТР теңестірудің екі тәсілі бар: электронды баланс және электронды – иондық баланс әдісі немесе жартылай реакция әдісі.
K2Cr2O7+3KNO2+4H2SO4(p)=Cr2(SO4)3+3KNO3+K2SO4+4H2O
 2Сr+6+6e=2Cr+3 1
2Сr+6+6e=2Cr+3 1
N+3-2e=N+5 3
Бұл әдіс – электрондық баланс әдісі.
Енді электронды- иондық баланс әдісі немесе жартылай реакция әдісі:
K2Cr2O7+3KNO2+4H2SO4(p)=Cr2(SO4)3+3KNO3+K2SO4+4H2O
1) Cr2O72- →2Cr3+.
Бұл әдіс реакцияның оң және сол жақ бөліктеріндегі атомдар балансына әкеліп соғады. ТТР рН<7 ортада жүргендіктен суды қолдануға болады. Реакцияның оң жақ бөлігіне сол жақ бөлігіндегі оттегінің санына байланысты 7 моль су қосамыз:

 Cr2O72-+14Н++6е→2Сr3++7Н2О
Cr2O72-+14Н++6е→2Сr3++7Н2О
+12 +6
Реакцияның оң жағында 14Н+ пайда болғандықтан сол жағын баланс үшін теңестіріп жазамыз. Енді зарядтар балансын тексереміз.

 2) NO2-+H2O-2e→NO3-+2H+
2) NO2-+H2O-2e→NO3-+2H+
Екінші теңдікте де сол жақта жетіспеген оттегі Н2О көмегімен енгізіледі де, оң жаққа 2Н+ қосылады, зарядтар балансы (-2е-).
Осы теңдіктерді қатар жазып, беріп жіберген және қосып алған «е» балансы үшін қойылатын коэффициентті табамыз:
 1 Cr2O72-+14Н++6е=2Сr3++7Н2О
1 Cr2O72-+14Н++6е=2Сr3++7Н2О
3 NO2-+H2O-2e=NO3-+2H+
Коэффициентті 3-ке көбейтіп, екі теңдікті біреу етіп жазамыз, ол үшін «+6е-» мен «-6е-» қысқартамыз:
Cr2O72- + 14Н++ 3NO2-+ 3H2O =2Cr+3+ 7H2O+ 3NO3- +6H+
8 4 3K+
2K+ 4SO42- 3K+ 3SO42- 2K++SO42-
Жетіспей тұрған K+ катионы мен SO42- анионын қосып, толық реакция теңдігін жазамыз:
K2Cr2O7+4H2SO4+3KNO2=Cr2(SO4)3+4H2O+3KNO3+K2SO4
ТТР жіктелуі:
1. Атомаралық н/се молекулааралық-әртүрлі молекуладағы элементтердің тотығу дәрежесінің өзгеруі арқылы жүреді:
Ғе+3Сl3- + 2Н+I -  2Ғе+2СI2- +I20 +HCl
2Ғе+2СI2- +I20 +HCl
2. Молекула ішілік – бір молекула құрамындағы элементтердің тотығу дәрежесі өзгереді:
2 К+Cl+5O3-2  2K+Cl- +3O20
2K+Cl- +3O20
3. Диспропорциялану – бір элементтің тотығу дәрежесін әрі жоғарылату, әрі төмендету арқылы жүруі.
4 К+Cl+5O3 -2  2К+Cl+7O4-2 +K+Cl-
2К+Cl+7O4-2 +K+Cl-
KMnO4 күшті тотықтырғыш қандай ортада: қышқылдық
ТТР-да т-ш,т-с-ш болатын: (Н2О2)
1.Атомаралық н/е молекулааралық ТТР
Молекулаішілік ТТР
Диспропорциялану ТТР
ТТР-ды:
а/ Электронды баланс әдісі
б/ Ионды-электрондық баланс н/се жартылай реакция әдісі арқылы теңестіреді.
«–» е- беру проц.- тотығу пр. –тотықсыздандырғыш;
«+» е- қосып алу проц.- тотықсыздану процесі – тотықтырғыш.
$$$241
Электрондық балансты қай реакцияда қолданады?
А) гидролиз;
В) тотығу-тотықсыздану;
С) бейтараптану;
D) сусыздану;
Е) ыдырау.
$$$ 242
Электронды қосып алатын бөлшек қалай аталады?
А) тотықтырғыш;
В) тотықсыздандырғыш;
С) активті бөлшек;
D) лигандтар;
Е) нейтралды молекула.
$$$ 144
Қай зат тек тотықтырғыш қасиет көрсетедi?
А) MnO;
В) MnO2;
С) K2MnO4;
D) KMnO4;
Е) MnCl2.
$$$ 145
Қайсы зат тек тотықсыздандырғыш қасиет көрсетедi?
А) S;
В) H2SO3;
С) H2S;
D) H2SO4;
Е) Na2SO3.
$$$ 146
Тотығу дәрежесi “+4” болатын ионы бар қосылысты көрсетiңiз.
А) Zn(OH)2;
В) HClO3;
С) KNO2;
D) Na2SO3;
Е) PbS.
$$$ 233
Төменде келтірілген реакциясының қайсы тотығу-тотықсыздану реакцияға жатады:
А) 5Na2SO3+ 2KMnO4 + 3H2SO4 ®5Na2SO4 + K2SO4 + 2MnSO4 +3H2O;
В) CaCl2 + H2SO4 ®CaSO4 + 2HCl;
С) AlCl3 + 3NaOH ®Al(OH)3 + 3NaCl;
D) (NH4)2CO3 ® 2NH3 + H2O + CO2;
Е) H2SiO3 ® H2O + SiO2.
1. NaCrO2+PbO2+NaOH®Na2PbO2+Na2CrO4+H2O
Берілген тотығу-тотықсыздану реакциясындағы тотықсыздандырғыштың моль санын табыңыз.
А) 3;
В) 2;
С) 4;
D) 5;
Е) 1.
2. Хлордың қайсы қосылысы тек тотықтырғыш қасиет көрсетедi?
А) KCl;
В) NaClO;
С) HClO4;
D) Ca(ClO3)2;
Е) KClO2.
3. Тотығу дәрежесi нольге тең затты көрсетiңiз.
А) Al;
В) PH3;
С) KOH;
D) HClO;
Е) NO2.
4. Оттектің тотығу дәрежесi “+2” болатын қосылысты көрсетiңiз.
А) OF2;
В) H2O;
С) KNO3;
D) Al2O3;
Е) Cu(OH)2.
5. Тотығу дәрежесi тұрақты болатын элементті көрсетiңiз.
А) Na;
В) Mn;
С) Cl;
D) N;
Е) S.
6. Күкірттің қайсы қосылысы әрі тотықтырғыш, әрі тотықсыздандырғыш қасиеттерді көрсетедi?
А) H2S;
В) Na2S;
С) H2SO4;
D) SO3;
Е) K2SO3.
7. Берiлген схемалардан, тотығу процесiн көрсетiңiз.
А) NO2-®NO3-;
В) SO42-®SO32-;
С) Cl2®2Cl-;
D) MnO4-® MnO2;
Е) Cu2+®Cu0.
8. Берiлген схемалардан тотықсыздану процесiн көрсетiңiз.
А) SO32-® SO42-;
В) S2-®S0;
С) MnO4-®MnO2;
D) NH3®NO3-;
Е) Cr3-®Cr0.
9. Берiлген реакциядағы тотықсыздандырғыштың эквивалентi неге тең:
K2Cr2O7+SnCl2+H2SO4®Sn(SO4)2+CrCl3+K2SO4.
M(K2Cr2O7)=294 г/моль; M(SnCl2)=190 г/моль.
А) 294/2;
В) 294/6;
С) 294/3;
D) 190/2;
Е) 190/4.
10. Азоттың төменгi және жоғарғы тотығу дәрежесi неге тең?
А) -3; +5
В) -3; +3
С) 0; +5
D) +2; +4
Е) +1; +5
11. ClO3- ионы Cl--на тотықсызданғанда қатысатын Н+ иондарының моль саны неге тең?
А) 2;
В) 3;
С) 5;
D) 8;
Е) 6.
12. Реакция теңдеуiнде тотықтырғыштың эквиваленті тең...:
HNO3+H2S®NO+S+H2SО4; M(HNO3)=63 г/моль; M(H2S)=34 г/моль.
А) 63/5;
В) 63/4;
С) 63/3;
D) 34/4;
Е) 34/2.
13. Орта ионының тотығу дәрежесi “+6” болатын қосылысты көрсетiңiз.
А) HNO3;
В) KMnO4;
С) K2Cr2O7;
D) H2S;
Е) H2O2.
$$$ 238
5Na2SO3+2KMnO4+3H2SO4®5Na2SO4+K2SO4+3H2O+2MnSO4
реакцияда тотықтырғышты анықтаңыз:
A) H2SO4;
B) KMnO4;
C) Na2SO3;
D) K2SO4;
E) Na2SO4.
14. Mg+HNO3®Mg(NO3)2+NH4NO3+H2O реакция теңдеуiн аяқтап, тотықсыздандырғыш алдындағы коэффициентiн анықтаңыз:
А) 2;
В) 4;
С) 8;
D) 10;
Е) 12.
15. Тотығу процесiн көрсетiңiз.
А) H3AsO3®H3AsO4;
В) As2O5®As2O3;
С) As2O3®AsH3;
D) H3AsO4®As2O5;
Е) As2O3®HАsO2.
$$$ 78
Сурьманың ( ) ең кіші және ең үлкен тотығу дәрежесiн көрсетiңiз:
) ең кіші және ең үлкен тотығу дәрежесiн көрсетiңiз:
А) (-3)-(+4);
В) (-2)-(+4);
С) (-1)-(+2);
D) (-3)-(+5);
Е) (-3)-(+3).
16. Тотықсыздану процесiн көрсетiңiз.
А) MnO4-®MnO2;
В) 2O-2®O2;
С) Fe®Fe+3;
D) 2Br-®Br20;
Е) NO2-®NO3-.
17. KMnO4+NaNO2+H2SO4®MnSO4+NaNO3+K2SO4+H2O
Берілген тотығу-тотықсыздану реакциясына қатысатын электрондар санын анықтаңыз:
А) 10;
В) 2;
С) 5;
D) 3;
Е) 6.
$$$ 68
Хлордың максималды тотығу дәрежесін көрсетіңіз.
А) -1;
В) +7;
С) -7;
D) +1;
Е) +5.
$$$ 254
2KMnO4+3H2SO4+5H2C2O4=2MnSO4+K2SO4+10CO2+8H2O
Берілген тотығу-тотықсыздану реакциясындағы тотықтырғыштың эквивалентінің молярлық массасын аңықтаныз:
A) 158 г/моль;
В) 31,6 г/моль;
С) 10,0 г/моль;
D) 15,8 г/моль;
Е) 3,16 г/моль.
$$$ 259
KJ + K2Cr2O7 + H2SO4 ® J2 + K2SO4 + Cr2 (SO4)3 + H2O
реакцияда K2Cr2O7 молекуласы қанша электрон қосып алады:
А) 2е;
В) 3е;
С) 4е;
D) 5е;
Е) 6е.
$$$ 82
Қай қатарда солдан оңға қарай электртерістік өседі?
А) Ca, Cl, Se, Al;
В) Na, H, N, F;
С) K, N, F, Mg;
D) P, Se, O, Ca;
Е) O, Br, I, H.
$$$ 83
Молекуладағы атомдардың электрондарын өзіне қосып алу қабілеттілігінің сандық сипаттамасы деп... аталады.
А) иондану энергия;
В) электронға ынтықтылық;
С) электртерістік;
D) диссоциациялану энергия;
РЕАКЦИЯ ЖЫЛДАМДЫҒЫ.
 2017-12-14
2017-12-14 2435
2435
