Реакцияға түскіш бөлшектерді активтілер деп, энергетикалық барьерді (асуды) жоюға қажетті энергияны активтендіру энергиясы дейді.
Әрекеттесуші заттарды активті комплекс күйіне өзгертуге, ауыстыруға қажетті энергияны активтендіру энергиясы дейміз.
Жылдамдық константасының активтендіру энергиясына тәуелділігі Аррениус теңдеуімен өрнектелінеді:
К=Z×P×e-Eа/RT
Z –соқтығысқан молекулалар саны әр секунд сайын;
е – натуральді логарифмнің негізі;
Р – бағытталған көбейткіш, молекуланың ыңғайлы орналасуын ескереді.
Химиялық тепе-теңдік. Кейбір химиялық реакциялар бір бағытта ғана жүреді. Мысалы: 2КClO3 ® 2KCl+3O2
Көптеген реакциялар қайтымды. Бастапқы заттар концентрациясының азаюы, реакция өнімдерінің концентрациясының өсуіне әкеледі. Реакция өнімдері өзара әрекеттесіп, бастапқы заттар түзіледі.
NO2+CO «NO+CO2
υ1=k1×CNO2×CCO. υ2=k2×CNO×CCO2.
υ1=υ2, осыдан k1×CNO2×CCO = k2×CNO×CCO2.
 н/се Кс н/се Кр
н/се Кс н/се Кр
Кс-тепе-теңдік концентрациясы.
Химиялық тепе-теңдіктің ығысуы. Ле-Шателье принципі
Химиялық тепе-теңдік жағдайы көптеген факторларға байланысты: температураға, қысымға, концентрацияға және т.б. Осы факторлардың біреуін өзгерткенде химиялық тепе-теңдік ығысады. Тепе-теңдікте тұрған жүйеде барлық қоспаның концентрациясын өзгертпей-ақ, осы заттардың біреуінің ғана концентрациясын өзгертуге болмайды.
Осы жағдайды 1884ж.ғалым Ле-Шателье былай тұжырымдады: Тепе-теңдікте тұрған жүйеге сырттан әсер етсе, тепе-теңдік сол жасаған жағдайға қарама-қарсы жаққа қарай ығысады.
Тепе-теңдік күйдегі жүйеге сырттан әсер еткенде, жүйеде осы әсерді азайтатын процесс күшейеді:
3H2+N2 «2NH3+46,2кДж
$$$ 184
2NO(г)+O2(г) ® 2NO2(г) гомогенді реакцияның жылдамдығына сәйкес келетін өрнектердің қайсысы дұрыс?
А) u = k×2CNO×  ;
;
В) u = k×  ×
×  ;
;
С) u = 2k×  ×CNO;
×CNO;
D) u = k×  +
+  ;
;
Е) u = k×  .
.
$$$ 185
S(к)+O2(г) ® SO2(г) гетерогенді реакцияның жылдамдығына сәйкес келетін өрнектердің қайсысы дұрыс?
А) u = k×CS×  ;
;
В) u = k×  ;
;
С) u = k×CS+  ;
;
D) u = k×  ;
;
Е) u = k×CS×  ×
×  .
.
Реакция жылдамдығының температуралық коэффициентi неге тең, егер температураны 400С-ге жоғарылатқанда реакция жылдамдығы 81 есе артса?
А) 1;
В) 2;
С) 3;
D) 4;
Е) 5.
$$$ 207
Қайтымды реакцияның қайсысында, қысымды жоғарылатқанда тепе-теңдiк тура реакция бағытына ығысады:
А) H2+I2 Û 2HI;
В) C+СO2 Û 2CO;
С) N2+O2 Û 2NO;
D) N2+3H2 Û 2NH3;
Е) 2HBr Û H2+Br2.
$$$ 208
Берiлген реакцияның 2NO(г)+O2(г) = 2NO2(г) жылдамдығы қалай өзгередi, егер көлемдi 3 есеге азайтса?
А) 6 есе төмендейді;
В) 20 есе артады;
С) өзгермейді;
D) 27 есе артады;
Е) 2 есе төмендейді.
$$$ 209
Берiлген реакцияның N2(г)+3Н2(г) Û 2NН3(г) жылдамдығы қалай өзгередi, егер жүйедегi қысымды 3 есе арттырса?
А) 3 есе азаяды;
В) 27 есе артады;
С) 81 есе артады;
D) өзгермейді;
Е) 120 есе артады.
$$$ 210
А2(г)+В2(г) Û 2АВ(г) реакцияның тепе-теңдiгi қай бағытқа ығысады, егер бiр уақытта қысымды 2 есе, температураны 100С-ке арттырса? Тура реакцияның температуралық коэффициентi 2-ге, керi реакцияның 3-ке тең.
А) солға;
В) оңға;
С) өзгермейді;
D) оңға, егер темп. коэф.=2;
Е) оңға, егер темп. коэф.=3.
$$$ 211
Реакцияның жылдамдық константасы қай шамаға тәуелдi:
А) көлем мен температураға;
В) әрекеттесетін заттардың табиғатына;
С) жүйедегі қысымға;
D) әрекеттесетін заттардың концентрациясына;
Е) қысым мен температураға.
$$$ 212
2А+В®А2В реакция жылдамдығы қалай өзгередi, егер А-заты концентрациясын 2 есе арттырып, ал B заты концентрациясын 2 есе азайтса?
А) 2 есе артады;
В) 4 есе артады;
С) 8 есе артады;
D) өзгермейді;
Е) 16 есе артады.
$$$ 213
Температураны 200С-тен 700С-ке арттырғанда реакция жылдамдығы қанша есе артады, егер реакцияның температуралық коэффициентi 2-ге тең болса?
А) 10 есе;
В) 15 есе;
С) 32 есе;
D) 16 есе;
Е) 30 есе.
$$$ 214
Келтiрiлген реакция N2+3Н2®2NН3 жылдамдығының математикалық теңдеун жазыңыз:
А) u=k1× 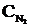 ×
× 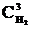 ;
;
В) u=k1×N2;
С) u=k1× 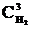 ;
;
D) u=k1×  ;
;
Е) u=k1× 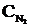 +
+ 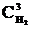 .
.
$$$ 215
Химиялық реакция жылдамдығының катализатор қатысуымен артуына үлесiн тигiзетiн:
А) активтену энергиясының артуы;
В) активтену энергиясының төмендеуi;
С) молекулалардың соқтығысу жиiлiгiнiң артуы;
D) реакция жылуының өсуi;
Е) реакция жылуының төмендеуi.
$$$ 216
Әрекеттесушi заттар концентрациясын арттырғанда реакция жылдамдығы:
А) артады;
В) төмендейді;
С) өзгеріссіз қалады;
D) бастапқыда артып, сонан соң төмендейдi;
Е) бастапқыда төмендейдi, сонан соң артады.
$$$ 217
2NO+O2®2NO2+Q реакция тепе-теңдiгi солға қарай қай жағдайда ығысады?
А) О2 концентрациясын арттыру;
В) температураны арттыру;
С) NO концентрациясын арттыру;
D) қысымды арттыру;
Е) NO2 концентрациясын азайту
$$$ 218
Вант-Гофф ережесiне сәйкес, температураны әрбiр 100С-ке көтергенде реакция жылдамдығы?
А) өзгермейді;
В) 2-4 есе өседі;
С) азаяды;
D) 10-20 есе артады;
Е) 5-10 есе кемиді.
$$$ 219
Гомогенді реакцияны көрсетіңіз.
А) С(қ)+О2(г)=СО2(г)
В) 4Al(қ)+3О2(г)=2Al2О3(қ)
С) CaСO3(қ) ®CaО(қ)+СО2(г)
D) N2(г)+3Н2(г) ®2NН3(г)
Е) 2KClO3(қ)  2KCl(қ)+3О2(г)
2KCl(қ)+3О2(г)
$$$ 220
4HCl(г)+O2(г)®2H2O(г)+2Cl2(г) реакциясының жылдамдығы HCl концентрациясын 2 есе өсiргенде қанша есе өседi?
А) 2;
В) 32;
С) 8;
D) 16;
Е) 34.
$$$ 221
Газдық фазада жүрiп жатқан реакцияның температурасын 320 дан 340К өсiргенде реакция жылдамдығы қанша есе өседi, егер g=3?
А) 8;
В) 9;
С) 6;
D) 3;
Е) 10.
$$$ 222
СО(г)+Н2О(г)=СО2(г)+Н2(г) реакцияның жылдамдығын 36 есе арттыру үшін қысымды қалай өзгерту керек?
А) 3 есе арттыру;
В) 6 есе арттыру;
С) 12 есе арттыру;
D) 4,5 есе арттыру;
Е) 9 есе арттыру.
$$$ 223
Реакция жылдамдығын 81 есе азайту үшiн температураны қанша градусқа төмендету керек, егер g=3 болса?
А) 200;
В) 300;
С) 200;
D) 400;
Е) 90.
$$$ 224
Fe3O4(қ)+4CO(г) Û 3Fe(қ)+4CO2(г) реакцияның тепе-теңдігі қысымды арттырғанда қалай өзгереді:
А) солға қарай ығысады;
В) СО2 түзілу жағына ығысады;
С) оңға қарай ығысады;
D) ығыспайды;
Е) Fe3O4 түзілу жағына ығысады.
$$$ 225
N2(г)+3H2(г) Û 2NH3(г) жүйесiндегi тепе-теңдiктi оңға, яғни аммиак түзiлу жағына ығыстыру үшiн:
А) қысымды арттыру керек;
В) қысымды кеміту керек;
С) аммиактың концентрациясын арттыру керек;
D) температураны азайту керек;
Е) газдардың көлемін арттыру керек.
$$$ 226
2CO(г)+O2(г) Û 2CO2(г)+Q жүйесiндегi тепе-теңдiктi солға, яғни бастапқы заттар жағына ығыстыру үшiн:
А) СО-нің концентрациясын арттыру керек;
В) О2-нің концентрациясын арттыру керек;
С) СО2-нің концентрациясын азайту керек;
D) температураны арттыру керек;
Е) қысымды арттыру керек.
$$$ 228
Химиялық реакцияның жылдамдығы қалай өзгереді, егер әрекеттесетін заттардың концентрациясын арттырса?
А) азаяды;
В) артады;
С) өзгеріссіз қалады;
D) реакция өнімдерінің концентрациясы азаяды;
Е) реакция өнімдерінің концентрациясы өзгермейді.
$$$ 229
Гетерогендi реакция үшiн С(қ)+СО2(г) ® 2СО(г) әсер етушi массалар заңының қайсы өрнегi дұрыс?
А) u= k × 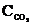 ;
;
В) u= k ×  ;
;
С) u= k +  ;
;
D) u= k × 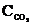 ×
×  ;
;
Е) u= k ×2  .
.
$$$ 231
Химиялық реакция жылдамдығының өлшем бірлігі:
А) моль/л;
В) моль/сек;
С) моль/л×сек;
D) л/моль;
Е) г/моль.
$$$ 232
Әсеретушi массалар заңың қолданып 2A + B® C реакцияның жылдамдығын анықтаңыз:
А) u = k×[A]×[B];
В) u = k×[C]2;
С) u = k×[A];
D) u = k×[A]2×[B];
Е) u = k×[B].
$$$ 236
Әсеретушi массалар заңың қолданып A +3D ® 2C реакцияның жылдамдығын анықтаңыз:
А) u = k×[C];
В) u = k×[A];
С) u = k×[D];
D) u= k×[A]×[D]3;
Е) u = k×2[C].
$$$ 240
2Н2 + СО  СН3ОН реакция үшін тепе-теңдік константасын өрнектеңіз:
СН3ОН реакция үшін тепе-теңдік константасын өрнектеңіз:
А) 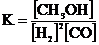 ;
;
В)  ;
;
С)  ;
;
D) 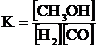 ;
;
Е) 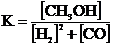 .
.
ХИМИЯЛЫҚ ТЕРМОДИНАМИКА. ТЕРМОХИМИЯ
Химиялық термодинамика – химиялық реакция кезінде байқалатын энергияның бір түрден басқа түрге айналуын, реакциялардың бағытын және реакциялардың осы жағдайда өздігінен жүру шегін, сонымен қатар химиялық тепе-теңдіктің болу жағдайларын анықтайтын ғылым.
Термодинамиканың 1-ші заңының матем.өрнегі: Q=∆U+A
Жүйе күйенің шексіз аз өзгерістерімен байланысты үрдістер үшін термодин.1-ші заңының матем. өрн., изохора проц.: dU = δQ + δA
Изобаралық проц. энергияның толық қоры Н – энтальпиямен сипаталады. ∆Н = ∆U + р∆V; ∆U мен ∆Н- күй функциялар; δQ ж/е δA
күй функциялары емес, олар жүйені процесс кезінде сипаттайды.
Газ тәрізді заттар үшін: ∆Н = ∆U + ∆νRT
Г.И. Гесс заңы. Жылу эффектісі және әрекеттесуші заттардың агрегаттық күйі көрсетілген химиялық реакция теңдеулерін термохимиялық теңдеулер деп атайды.
СН4(г)+2О2(г)=СО2(г)+2Н2О(с)+802кДж
298К н/се 25ºС ж/е р0-101,3кПа н/се1атм. қ.ж.-ғы мәнді стандартты жылу эффектісі деп DН0f,298 белгілейді, /кДж, ккал/.
Іс жүзінде жылу эффектілерін калориметрмен анықтайды.
Петербург химигі Г.И.Гесс 1840ж.тұжырымдаған: реакцияның жылу эффектісі оның жүрген жолына тәуелді емес, тек қана алынған зат пен реакция өнімінің табиғатымен және күйімен анықталынады.
∆rНº298 = ∑νөн.∆Нƒ, 298 өн. ∑νбас.∆Нƒ,298 баст.
ƒ – инд. ағылш. «formation» - түзілу.
Процестердің бағыты. Изобаралық потенциал. Гиббс энергиясы
Термодинамиканың екінші заңы бойынша ішкі энергия және энтальпия: U = F + TS; H = G + TS
Гиббс(G) және Гельмгольц (F) энергиялары жүйенің термодинамикалық күй функциялары, оларды «еркін» энергиялар деп атайды. Жүйенің ішкі энергиясының қалған бөлігі жұмысқа ауыса алмайды, жүйеде қалып қояды және сол себептен «байланысқан» энергия деп аталады.
Байланысқан энергия жүйенің энтропиясымен анықталады және ол абсолюттік температураны энтропия өзгерісіне көбейткенге тең, яғни TdS немесе TΔS:
dG ≤ dH − TdS; ΔG ≤ ΔH − TΔS
dF ≤ dH − TdS; ΔF ≤ ΔH − TΔS
Бұл теңдеулер Т-const. ж/е V-const. н/се сәйкес қысымда қайтымды (=) және қайтымсыз (<) үрдістер үшін жазылған.
Термодинамикалық функция өзгерістерін (ΔG, ΔF) кез келген реакция үшін жылу эффектілері сияқты Гесс заңы бойынша есептейді. Қ.ж. (25°С және 101325 Н/м2) термодинамикалық функцияның шамалары анықтама кітабында беріледі: Gºреак=SDGºөнім-SDGºбаст.зат. /кДж/моль, ккал/моль./
Жай заттың ең тұрақты модификациясының түзілуінің DG0298 –мәні нөлге тең.
Термодинамиканың 2-ші заңының матем.өрнегі: dS ≥ δQ/T; ΔS ≥ Q/T
мұнд.: > белгісі қайтымсыз, ал = белгісі қайтымды үрдістер үшін.
Энтропия S – термодинамикалық күй функциясы, ол экстенсивтік қасиет көрсетеді, яғни жүйенің массасына тәуелді; /Дж/моль•К./
Термодинамикалық ықтималдық W мен жүйенің ретсіздікке ұмтылуын сипаттайтын термодинамикалық күй функциясы энтропия S арасындағы байланыс Больцман формуласымен өрнектеледі: S = klnW
k − Больцман конст., 1,38 · 10 23 Дж/к.
Ішкі энергия мен энтальпиядан өзгешелігі энтропияның абсолюттік мәні анықталған болу мүмкіндігі. Энтропия мәні заттардың табиғатына (молекула күрделенген сайын оның энтропиясының жоғарылауы, мысалы, S0CO =197Дж /моль·К, ал S0CO2 = 214 Дж/моль·К) және агрегаттық күйіне (ең үлкен энтропия мәні газ тәріздес күйдегі, кішілері сұйық және қатты заттарда, мысалы, S0H2O(с) = 70 Дж/моль·К, ал S0 H2O(г) = 189 Дж/моль·К).
Қ.ж. Т=298К ж/е р=1,013·105Па (1атм.) стандарттық энтропия S0 болады. ∆Sреак. = ∑(νi Ѕ°)өнім - ∑(νi Ѕ°)баст.
Термодинамика заңы бойынша: жай заттың түзілу энтальпиясынан өзгешілігі жай затттың энтропиясы нольге тең болмайды.
Термодинамиканың I заңы.
Физикалық химия – химиялық құбылыстар мен химиялық процестердің заңдылықтарын зерттейтін ғылым.
Термодинамиканың негізгі түсініктері. Жүйе дегеніміз кеңістіктің бір бөлігі. Ашық жүйе қоршаған ортамен энергияны және затты алмастырадын жүйе.. Жабық жүйе – қоршаған ортамен тек энергияны алмастырадын жүйе.
Оқшауланған жүйе - қоршаған ортамен затты да, энергияны да алмастырмайтын жүйе. Оқшауланған жүйенің ішкі энергиясы тұрақты шама.
Жүйелер гомогенд і және гетерогенді деп екі топқа бөлінеді.
Гомогенді жүйе деп біркелді, бірфазалы жүйені айтады.
Гетерогенді жүйе деп біркелкісіз, көпфазалы жүйені айтады.
Фаза деп жүйенің басқа бөліктерінен шекарамен бөлінген, кез-келген нүктесінде физикалық және химиялық қасиеттері бірдей жүйенің бір бөлігін айтады.
Энтальпия - ішкі энергия, көлем және қысым арасындағы байланысты көрсетеді және өзі кеңіген жүйенің ішкі энергиясы болып келеді:
Н = U + PV (3.1)
dН = dU + PdV +VdP
U, P, V – күй функциялары, өйткені оның өзгерісі процестің жүру жолына тәуелсіз.
Жылу мен жұмыс процестің функциялары болып саналады. Жылу мен жұмыстың мөлшері жүйенің бір күйден басқа күйге ауысқандағы жүру жолына тәуелді.
Жылусыйымдылық. Заттың бір грамының не бір молінің температурасын бір градусқа көтеру үшін жұмсалатын жылу мөлшерін жылусыйымдылық деп атайды. Заттардың жылусыйымдылығы температураға тәуелді, сондықтан жылусыйымдылықтың мәні нақтылы және орташа болып бөлінеді.
Орташа жылусыйымдылық деп берілген екі температура аралығындағы оның мәнін айтады:
 (3.2)
(3.2)
Нақтылы жылусыйымдылық деп берілген температурадағы жүйе жылусыйымдылығын айтады:
 (3.3)
(3.3)
Заттың 1 кг тиісті жылусыйымдылық – меншікті жылусыйымдылық деп, ал 1 моліне тиістісі мольдік жылусыйымдылық деп аталады.
Процесті өткізу жағдайына байланысты жылусыйымдылықты (P=const) изобаралық Ср және (V=const) изохоралық Cv деп бөледі.
Жылусыйымдылықтың мәніне температура үлкен әсер етеді.
Жылусыйымдылықтың температураға тәуелділігі дәрежелік қатарлармен беріледі:
органикалық қосылыстар үшін: Ср = a + bT +cT2 + dT3
анорганикалық қосылыстар үшін: Ср = a + bT +c1 T-2
a, b, c, d, c1 – заттардың табиғатына тәуелді коэффициенттер.
Термодинамиканың I заңының анықтамалары және математикалық теңдеуі
I ші термодинамиканың заңын М.В. Ломоносов 1748ж. ашқан, ол жалпы энергия сақталу заңының салдары болып келеді; оның бірнеше анықтамалары бар:
1. энергия жойылмайды, жоқтан пайда болмайды, ол тек қана бір түрден басқа түрге қатаң эквивалентті мөлшерде ауысады.
2. кез-келген оқшауланған жүйеде энергияның жалпы қоры тұрақты сақталады.
3. Iші текті мәңгілі қозғалтқыш болуы мүмкін емес. Кез-келген процесс үшін жүйенің ішкі энергиясының көбеуі ∆U=U2-U1 жүйеге берілген жылу мөлшері (q) мен жүйемен атқарылған жұмыс мөлшерінің (А) айырымына тең.

Шексіз аз мөлшерінде жүретін процестер үшін термодинамиканың I ші заңы келесі түрде жазылады:

Қарапайым процестер үшін термодинамиканың I заңының қолдануы
1. Изохоралық процесс (V = const):
А = 0, онда qv = DU
2. Изобаралық процесс (Р=const):
Ap = P (V2 - V1) = P DV (3.9)
qp = DU + P DV, яғни
DH = DU + PDV, онда
qp = DH (3.10)
3. Изотермиялық процесс (T = const).
Менделеев-Клапейронның теңдеуінен қысымның мәнін көрсетеміз: 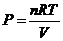 , оны жұмыстың теңдеуіне қоямыз:
, оны жұмыстың теңдеуіне қоямыз:
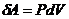 ;
;  ,
,
 (3.11)
(3.11)
T = const жағдайда, ∆U = 0 екенін есепке алып, изотермиялық процестер үшін термодинамиканың I заңы келесі теңдеу түрінде болады
qT=AT (3.12)
4. Адиабатикалық процесс қоршаған ортамен жылу алмастырмайды, яғни q = 0, сондықтан
A = - DU (3.13)
Адиабатикалық процестін жұмысы жүйенің ішкі энергиясының кеміуі арқылы атқарылады. Ол келесі теңдеумен есептеледі:
 (3.14)
(3.14)
Термохимия.
Термохимия деп химиялық реакциялардың жылулық эффектілерін зерттейтін химиялық термодинамиканың бөлігін айтады.
Реакция жүргенде бөлінген немесе жұтылған жылу мөлшерін химиялық реакцияның жылу эффектісі деп айтады. Реакция келесі жағдайларда жүру қажет:
1) P = const; Т = const болғанда, реакция қайтымсыз болуы қажет;
2) кеңу жұмысынан басқа жүйеде ешқандай жұмыстар атқарылмау қажет;
3) реакция өнімдерінің және бастапқы заттардың температуралары бірдей болуы қажет.
V = const және P= const жағдайлардағы химиялық реакциялардың жылуларын жылу эффектілер деп атайды: qV = DU; qP = DН.
Реакция жүргенде жылу жұтылатын болса, DН > 0, мұндай реакциялар эндотермиялық реакциялар деп аталады.
Реакция жүргенде жылу бөлінетін болса, DН < 0, мұндай реакциялар экзотермиялық реакциялар деп аталады.
V =const және P = const жылу эффектілерінің арасындағы байланысты келесі теңдеу көрсетеді:
qP = qV + DnRT, (3.15)
мұнда: Dn – реакцияға қатысатын газды заттардың моль санының өзгеруі.
Термохимиялық реакцияны жазғанда заттардың агрегатты күйлерін ескеру қажет.
Гесс заңы
V = const және P=const жағдайларда химиялық реакцияның жылу эффектісі реакцияның жолына тәуелсіз, ол тек жүйенің бастапқы және соңғы күйлерімен анықталады.
Гесс заңы эксперименталды түрде анықтауға келмейтін химиялық реакциялардың жылу эффектілерін есептеуге мүмкіншілік береді.
Гесс заңының салдарлары:
I. Реакцияның түзілу жылу эффектісі реакция өнімдері мен бастапқы заттарының түзілу жылуларының қосындыларының айырымына тең.

 (3.16)
(3.16)
мұнда: DНr – реакцияның түзілу жылу эффектісі
D fН0 – 1 моль заттың қарапайым заттардан түзілу жылуы.
II. Реакцияның жылу эффектісі реакцияға түскен заттар мен реакция өнімдерінің жану жылуларының қосындыларының айырымына тең

 (3.17)
(3.17)
Жану жылу деп берілген жағдайларда 1 моль заттың жоғары оксидтерге дейін тотыққанда бөлініп шығатын жылуды айтады.
Реакция жылу эффектісінің температураға тәуелділігі
Молярлық жылусыйымдылықтардың теңдеулерін жазайық:
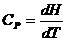 және
және  (3.18)
(3.18)
Жылусыйымдылықтың шамалы өзгеруі келесі теңдеулермен көрсетіледі:
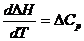 (3.19)
(3.19)  (3.20)
(3.20)
(3.19) және (3.20) теңдеулер Кирхгофтың дифференциалды теңдеулері деп аталады. Олар жылу эффектінің температуралық коэффициентінің реакция өнімдері мен бастапқы заттардың қосындыларының айырымына тең екенін көрсетеді.
(3.19)-ші теңдеуді талдайық.
1. Егер DСР > 0, онда  . Температура жоғарлаған сайын реакцияның жылу эффектісі өседі.
. Температура жоғарлаған сайын реакцияның жылу эффектісі өседі.
2. Егер DСр < 0, онда  . Температура жоғарылаған сайын реакцияның жылу эффектісі кемиді.
. Температура жоғарылаған сайын реакцияның жылу эффектісі кемиді.
3. Егер DСР = 0, онда  . Реакцияның жылу эффектісі температураға тәуелсіз.
. Реакцияның жылу эффектісі температураға тәуелсіз.
Т1 және Т2 аралығында Кирхгоф теңдеуін интегралдасақ келесі теңдеулерді аламыз:
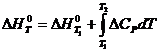 (3.21)
(3.21)
Т1 = 298К тең деп алатын болсақ, онда Кирхгофтың теңдеу былай өзгереді:
 (3.22)
(3.22)
(3.21) және (3.22) теңдеулер интегралды түрдегі Кирхгоф теңдеулері.
Егер D CP = const, онда (3.22) келесі түрде болады:
Термодинамиканың екінші заңы. Энтропия
4.1 Термодинамиканың II заңының анықтамалары
Ешқандай сыртқы әсерлердің көмегінсіз жүретін процестерді өздігімен жүретін процестер деп айтады. Энергия жұмсалғанда ғана жүретін процестерді өздігінен жүрмейтін процестер деп айтады. Процестер қайтымды және қамтымсыз болуы мүмкін. Термодинамиканың II заңы процесс өздігінен жүре алатынын көрсетеді:
1.жылу өздігінен суық денеден ыстық денеге ауыспайды
2. процестің нәтижесі тек жылудың жұмысқа айналуы болса, ол іске аспайды
3. II ші текті мәңгілі қозғалтқыш болуы мүмкін емес (яғни, ол қоршаған ортаның салқындауы арқылы жұмыс атқаратын қолғалтқыш болып табылады).
Термодинамиканың екінші заңының математикалық теңдеуін шығару үшін жылудың жұмысқа айналу кестесін қарастырайық:
орындалған жұмыстың (А) қыздырғыштан алынған жұмысшы дененің жылу мөлшеріне (q1) қатынасы пайдалы әсердің термодинамикалық коэффициенті деп аталады:
ПӘК =  , (4.1).
, (4.1).
мұнда: q1 – қыздырғыштан алынған жылу;
q2 – суытқышқа берілген жылу.
ПӘК қыздырғыш (Т1) және суытқыштың (Т2) температураларына тәуелді (4.1) теңдеуді келесі түрде жазамыз:
 немесе
немесе  (4.2)
(4.2)
 шаманы процестің келтірілген жылу дейді.
шаманы процестің келтірілген жылу дейді.
Энтропия
Неміс физигі Р. Клаузиус қайтымды изотермиялық процесс үшін процестің келтірілген жылуы оның күй функциясы екенін көрсетті. Бұл шаманы энтропия (S) дейді, ол жұмысқа айналдыруға болмайтын, яғни байланысқан энергияның мөлшері болып келеді:
 (4.3)
(4.3)
ал қайтымды ауысудың шексіз аз жылу мөлшері (dq) үшін
 (4.4).
(4.4).
(4.3) және (4.4) теңдеулерді қайтымды процестер үшін термодинамиканың II заңының математикалық теңдеулері дейді.
4.3 Әртүрлі процестер үшін энтропия өзгерістерін есептеу
4.3.1 Қайтымды изотермиялық процестер үшін
 (P = const) (4.5)
(P = const) (4.5)
мұнда: DН – өзгерістің жылуы
Т – өзгерістің температурасы.
Келтірілген теңдеу арқылы фазалық өзгерістердің (қайнау, балқу, айдау) энтропиясының өзгерісін (DS) есептейді.
4.3.2 Р=const жай жүретін, қайтымды процеске жуық температураның өзгеруі үшін:
 (4.6)
(4.6)

 (4.7)
(4.7)
4.3.3 Идеалды газ энтропиясының өзгеруі.
Термодинамиканың I және II заңдарының теңдеулерін қолданып, келесі теңдеу аламыз:
TdS = cVdT+PdV
 (бір моль үшін)
(бір моль үшін)
 немесе
немесе
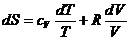 (4.8)
(4.8)
(4.8) теңдеуді интегралдаймыз:
 (4.9) немесе
(4.9) немесе
 (4.10)
(4.10)
Демек, V мен Т жоғарылаған сайын энтропия өседі және Р өскен сайын төмендейді.
4.3.4 Қайтымсыз процестер үшін
Қайтымды процестер үшін жұмыстың шамасы әрқашанда қайтымсыз процестерге қарағанда үлкен болады, ал ішкі энергияның өзгеруі күй функциясы ретінде процестің жүру жолына тәуелсіз, демек
dАқай-сыз<dАқай-ды
dUқай-сыз=dUқай-ды
Онда термодинамиканың бірінші заңынан: dq = dU+dA
Келесі теңдік шығады: dqқай-сыз<dqқай-ды немесі
 ,өйткені
,өйткені
 ,онда
,онда
 , немесе
, немесе  (4.11)
(4.11)
(4.11) теңдеу термодинамиканың II заңының қайтымсыз процестер үшін теңдеуі. (4.4) және (4.11) біріктіретін болсақ, кез-келген процестер үшін термодинамиканың II заңының теңдеуін аламыз:
 немесе
немесе  (4.12)
(4.12)
Оқшауланған жүйеде қоршаған орта мен жылу алмасу жоқ, демек
dq = 0, онда d S≥0 (4.13).
Демек, егер оқшауланған жүйеде өздігінен (қайтымсыз) процесс жүргенде, жүйенің энтропиясы жоғарылайды және тепе-теңдік орныққанда өзінің максималды шамасына келеді.
4.4 I және II термодинамиканың заңдарының біріккен теңдеуі
I термодинамикиның заңы: II термодинамиканың заңы:
dq = dU+PdV dq = TdS
Қайтымды процесс үшін: Қайтымсыз процесс үшін:
TdS = dU+PdV (4.14) TdS>dU+PdV (4.15)
Кез-келген процесс үшін:
TdS³dU+PdV (4.16)
4.5 Энтропияның статистикалық мазмұны
Энтропияның физикалық мағынасын түсіндіру үшін 1877ж. Больцман термодинамикалық ықтималдық (W) деген түсінік еңгізді.
Мұнда: W – термодинамикалық ықтималдық
Макрокүйді құрайтын микрокүйлердің саны термодинамикалық ықтималдық деп аталады.
S = кlnW (4.17)
мұнда: к – Больцман тұрақтысы, ол  тең. Онда 1 моль үшін
тең. Онда 1 моль үшін
S = RlnW (4.18)
Демек, энтропияның шамасы жүйенің күй ықтималдығының мөлшері болып келеді. Жүйенің ретсіздігі жоғары күйге ауысуы (мысалы, қайнау немесе балқу), демек ықтималдығы жоғары күй әрқашанда энтропияның өсуіне әкеледі.
4.6 Гельмгольцтың және Гиббстың бос энергиялары
Оқшауланған жүйелерде энтропияны процестің бағытын анықтау үшін қолдануға болады. Іс жүзінде көбінесе процестер ашық және жабық жүйелерде жүреді, сондықтан олардың жүру бағытын сипаттайтын басқа тепе-теңдік критерийлерді талдау қажет.
I және II термодинамика заңдарының біріккен теңдеуін жазайық:
dA £ TdS-dU (4.19)
температура тұрақты шама болғандықтан, оны дифференциалдың таңбасының астына еңгізуге болады:
dA £ -d(U-TS) (4.20)
онда изотермиялық процесс үшін жұмыс кейбір (U-TS) функцияның кемиуне тең.
Бұл функцияны (U-TS) = F және оны Гельмгольц бос энергиясы немесе изохоралы-изотермиялық потенциал деп айтады.
(4.20) теңдеу келесі түрде жазылады:
dA £- d F (4.21)
(4.21) теңдеуден көруге болады U=F+TS, яғни ішкі энергия екі бөлімнен түрады: F – жұмысқа толық айналдыруға келетін бос энергиядан және TS – жұмысқа ешқандай жағдайда айналмайтын байланысқан энергиядан
T = const, V = const, dА = 0 және dF £ 0. (4.22)
Қорытынды: Т=const және V=const жағдайларда Гельмгольц энергиясы деп қайтымды изотермиялық процесс жүргенде жұмысқа толық айналдыруға келетін ішкі энергияның бөлігін айтады. Бірақ техникада көбінесе процестер P=const жағдайда жүреді. Онда орындалатын жұмыс:
dA = РdV, осыдан РdV £ -dF, немесе
dF+РdV£0, d(F+РV)£0.
G = F+РV (4.23) деген шаманы еңгізетін болсақ, онда DG£0 (4.23)
G деген шаманы Гиббстің бос энергиясы немесе изобаралы-изотермиялық потенциал дейді.
G = F+РV = U-TS+pV = H-TS
dG = dH-TdS
DG=DH-TDS (4.24)
Гиббс энергиясының минимумы тепе-теңдік жағдайдың критериі болып келеді. Егер берілген процесс үшін Гиббс энергиясы кемитін болса, процесс өздігінен жүреді.
Гиббс-Гельмгольц теңдеулері Гиббс және Гельмгольц бос энергияларының өзгерісін, процестің жылуын және олардың температуралық түындыларын байланыстырады:
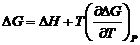 (4.25)
(4.25)
 (4.26)
(4.26)
4.7 Фазалық өзгерістер үшін термодинамиканың II заңын қолдану
Химиялық реакциясыз заттың бір фазадан екінші фазаға ауысу процестерін фазалық өзгерістер дейді. Бұл процестерге: булану, айдау, балқу, полиморфты өзгерістер жатады.
P = const, T = const жағдайда 1 моль заттың бір фазадан екінші фазаға тепе-теңдікті ауысуын қарастырайық. Екі күй үшін Гиббс энергиясының толық дифференциалын жазайық:
dGI = VIdP-SIdT
dGII = VIIdP-SIIdT
Екінші теңдеуден бірінші теңдеуді алып тастаймыз
dGII-dGI = (VII-VI)dP-(SII-SI)dT.
Тепе-теңдік орныққанда dGI = dGII, онда
 ,
,
мұнда VII-VI = DV – екі фазаның молярлық көлемдерінің айырымы. Фазалар өзара өзгерісін тепе-теңдік және изотермиялық деп қарастырамыз, онда SII-SI = DS тең деп алуға болады, онда
 =
=  (4.27)
(4.27)
мұнда: q – фазалық өзгерістің жылуы
 (4.28)
(4.28)
(4729) Клаузиус-Клапейронның фазалық өзгерістер үшін теңдеуі.
Полиморфты өзгерістер мен балқу процестері үшін көлемнің өзгеруі DV шамалы. Булану және айдау процестері үшін көлемдердің айырымы біраз шамаға жетеді, өйткені Vс және Vқ бу көлемінен көп есе кем болады, яғни Vбу >> Vқ. Бұл процестер үшін Vс және Vқ ескермеуге болады, онда булану процесі үшін теңдеу келесі түрде болады:
 (4.29)
(4.29)
Vбу идеалды газ күйінің теңдеуіне бағынады деп есептесек  , онда те4деу
, онда те4деу
келесі түрге келеді:
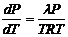 және
және  (4.30)
(4.30)
(4.31) интегралын аламыз:
 (4.31)
(4.31)
ln P - 1/T координаталарда график салып, сызықтың қисаю бұрышының тангенсінен булану жылуын есептеуге болады.
Интегралдауды Т1 және Т2 аралығында жүргізетін болсақ, келесі теңдеу аламыз:
 , (4.32)
, (4.32)
$$$ 246
Аммиактың (NH3(г)) стандартты түзілу жылуын табыңыз, егер оның тотығуы келесі термохимиялық теңдеу бойынша өтсе:
4NH3(г)+3О2(г)=2N2(г)+6Н2О(с); ∆rН0298 = -1530кДж, ∆fН0298(Н2О(с)) = -285,84кДж.
А) -16кДж;
В) 55,1кДж/моль;
С) -46,26кДж/моль;
D) 0;
Е) 46,26кДж/моль.
$$$ 247
Fe2O3(к)+3CO(г)=2Fe(к)+3CO2(г) реакцияның жылулық эффектісі (-26,8 кДж) бойынша темiр(III) оксидiнiң түзiлу жылуын (∆fН0298) табыңыз:
∆fН0298(CO)=-110,5 кДж, ∆fН0298(CO2)=-393,51 кДж.
А) 60кДж/моль;
В) -822,2 кДж/моль;
С) 55,1 кДж/моль;
D) -16,5 кДж/моль;
Е) 65,5 кДж/моль.
$$$ 248
Түзілу энтальпиясы деп... айтады
А) кристалды тордың энергиясын;
В) еріген зат иондарының су молекулаларымен әрекеттесу қарқындылығын;
С) жүйе энергиясының төмендеуін;
D) ретсіздіктің сандық мөлшерін;
Е) 1 моль күрделі заттың қарапайым заттардан түзілу реакциясының жылулық эффектісін.
$$$ 249
Қай заң термохимияның негізгі заңы болып келеді?
А) Бойля-Мариотта;
В) Менделеев-Клапейрон;
С) Авогадро;
D) Ломоносов;
Е) Гесс.
$$$ 250
Кальций гидроксидінің молярлық массасының мәнін (M(Ca(OH)2) көрсетіңіз:
А) 74 г;
В) 0,74 г;
С) 7,4 г;
D) 74г/моль;
Е) 740 г;
$$$ 251
Графитті жандырғанда массасы 8,86 г көмір(IV) оксиді түзіледі. Реакция жылулық эффектісі ∆rН=-79,2кДж тең. 1 моль СО2-нің қарапайым заттардан түзілу жылуын есептеңіздер.
А) 0;
В) 393,3 кДж/моль;
С) -601,9 кДж/моль;
D) -393,3 кДж/моль;
Е) 3456,7 кДж/моль.
ЭЛЕКТРОХИМИЯ. ЭЛЕКТРОЛИЗ. ГАЛЬВАНИКАЛЫҚ ЭЛЕМЕНТ. МЕТАЛДАРДЫҢ КЕРНЕУ ҚАТАРЫ. КОРРОЗИЯ
Электрохимия – химиялық реакция әсерінен электр тоғы пайда болуын және электр тоғының әсерінен тотығу-тотықсыздану реакцияларының жүруін зерттейді.
1.Процесс гальваникалық элементтерде іске асырылады.
2.Процесс электролиттік ванналарда немесе электролиздерде жүреді.
Электродтық потенциалдар. Сутектік жартылай элемент
Металдардың активтілігіне байланысты суда немесе өз тұздарының ерітінділерінде олардың ерігіштік қабілеті әр түрлі. Активті металдар тұздарының ерітінділерінде еріп, теріс зарядталады. Пассивті металдар ерітіндісіне батырғанда ерімейді, керісінше ерітіндіде металл бетіне көшіп, оң зарядтайды, аниондар оң пластинкаға тартылып, ерітіндіні теріс зарядтайды. Осы жағдайда қос электрлік қабат ҚЭҚ пайда болады. Оны электродтық потенциал деп атайды.
Металдың электродтық потенциалының сандық мәні металдың табиғатына, ерітіндідегі иондардың концентрациясына, температураға тәуелді болады. Осы тәуелділікті Нернст теңдеуімен сипаттайды:
Е=E0 +  ln аМеz+
ln аМеz+
Тұрақтыларды орнына қойып есептегенде және натураль логарифмді ондық логарифмге ауыстырғанда Нернст теңдеуі былай жазылады:
Е=E0 +  lg аМеz+
lg аМеz+
Металдардың электрохимиялық кернеу қатары
Барлық металдардың потенциалдары өлшенген және металдардың электрхимиялық активтілігінің қатары – кернеу қатары жасалған. Бұл қатар сілтілік металдардан басталады. Потенциалдары оң және теріс металдар потенциалы 0-ге тең сутегімен бөлінген.
| Металдардың кернеу қатары | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Кернеу қатарынан екі жағдай туады: 1) сутегіге дейін тұрған металдар тотықтырғыш емес қышқылдар құрамынан сутегін ығыстырып шығарады; 2) алдында (сол жақта) орналасқан металл кейін (оң жақта) тұрған металды ығыстырып шығарады.
1) Zn+2HCl=ZnCl2+H2
2) Ag +CuSO4 = жүрмейді
Электродтық потенциалды өлшеу үшін сутектік жартылай элементті қолданады.
Жартылай элемент – электродтан (металл пластинкасы) және электролит ерітіндісінен тұратын жүйе.
|
 Сутектің нөлге тең потенциалына салыстырылып металдардың потенциалдары өлшенген және ол металл потенциалы деп бекітілген.
Сутектің нөлге тең потенциалына салыстырылып металдардың потенциалдары өлшенген және ол металл потенциалы деп бекітілген. Гальваникалық элементтер теориясы
Екі жартылай элементтен тұратын жүйе гальваникалық элемент деп аталады. Гальваникалық элементте бір электрод ериді, екіншіде металдар немесе сутегі катиондары тотықсызданады.



 Мысалы:
Мысалы:
(-) Zn0 Zn+2 Cu+2 Cu0 (+)
Потенциал Zn EZn0= -0,76B, потенциал Cu ECu0= +0,34B.
Zn-электродының потенциалы теріс таңбалы болғандықтан ол активтілеу, ериді және электрондар цинк пластинасынан бірінші ретті өткізгіш пен өлшегіш құрал арқылы екінші мыс электродына ағады, онда мыс катиондары тотықсызданады (1- сурет).
|
 |
|
Даниэль-Якоби гальваникалық элементі
Процестің химизмі:
Zn0-2e=Zn2+, тотықсыздандырғыш;
Cu2++2e=Cu0, тотықтырғыш.
Гальваникалық элемент дегеніміз-өздігінен тотығу-тотықсыздану реакциясы жүретін, одан пайда болған энергия электр энергиясына айналатын жүйе.
Гальваникалық элементтерді тізбектей қоса отырып, қуаты бар батерея алады.
Гальваникалық элементтің электр қозғаушы күші ЭҚК болады:
ЭҚК =Ет-ш-Ет-сызд-ш, ЭҚК – мәні барлық уақытта оң таңбалы. Сонымен:
ЭҚК=ECu0 – EZn0 =+0,34-(-0,76)=1,1B.
Егер тұздар концентрациясы 1М емес басқа болса, онда электродтар потенциалдары Нернст формуласын пайдаланып табылады.
Оның көрінісі мынадай:

Тұрақтылар R,T,F мәнін қойып және ln=2,303lg есептеп, мынадай формула аламыз:

мұндағы: n – металл валенттілігі немесе электрондар саны.
Есеп: Fe/Fe2+(10-3моль/л) // Sn2+(10-1моль/л) / Sn жүйесінің ЭҚК-н табыңыз.
Нернст формуласын пайдаланып, темір мен қалайының потенциалдарын табамыз:


ЭҚК=ЕSn-ЕFe=-0,169-(-0,527)=+0,358B
Электролиз. Электролиз дегеніміз – электролит арқылы электр тоғы өткенде жүретін тотығу-тотықсыздану процесі.
Электролиз кезінде гальваникалық элементтегі сияқты анодта тотығу, катодта тотықсыздану процесі жүреді.
Электролиз процесі гальваникалық элементтің жұмыс істеу принципіне қарама-қарсы болғандықтан, электролиз кезінде теріс электрод - катодтық, ал оң электрод - анодтық қызмет атқарады.
Электролит табиғатына және электролит материалына байланысты электролиздің үш түрі бар:
1) судағы ерітіндінің индифферентті электрод арқылы электролизі;
2) балқымалар электролизі;
3) еритін анодпен электролиз, яғни рафинадтау – металдарды тазалау.
Фарадей заңдары
І- заңы. Электродта бөлінген заттың массасы электролит арқылы өткен ток мөлшеріне тура пропорционал: m=I∙t
m – граммен алынған масса;
I – ток күші, А;
t - секундпен өлшенген уақыт.
II- заңы. Электролиз кезінде тоқтың бірдей мөлшері электродтарда әртүрлі заттардың эквиваленттілік массасын бөліп шығарады:

А – атомдық масса;,
n – «е» саны, яғни оның қосылыстардағы заряды;
F – Фарадей саны=96500Кл.
Металдар коррозиясы. Металдардың өзін қоршаған орта әсерінен бұзылуын (тотығуын) коррозия деп атайды. Ортаға байланысты коррозияның бірнеше түрін ажыратуға болады:
1) химиялық немесе газ әсері;
2) электрохимиялық;
3) жер асты;
4) адасып жүрген тоқ (жер астында) арқылы коррозия.
Химиялық немесе газ әсерінен коррозия ауада жүреді. Ауа құрамы мынадай:
N2 (78,08%), O2 (20,95%), CO2 (0,03%), H2O, H2 (5∙10-5%), H2S, SO2, SO3, NO, N2O3, NO2, Cl2, NH3 және т.б.
Ауада металл бірден тотықтырғыштардың, көбінесе оттегінің әсеріне ұшырайды. Мысалы: темір, созылған ыстық темір бірден тотығып, оксид береді.
2Fe+O2
 2017-12-14
2017-12-14 2966
2966








