Химиялық өзгерістердің жылдамдығы мен механизмін химияның ерекше жеке бөлімі – химиялық кинетика зерттейді.
Реакциялар гомогенді және гетерогенді болады. Гомогенді реакциялар біртекті, гетерогенді реакциялар әртекті фазалар шегінде жүреді.
Реакция жылдамдығы, әдетте, әрекеттесуші заттар концентрациясының уақыт аралығындағы өзгерісін сипаттайды. Ерітінділерде концентрация – моль/л, газдарда – парциальды қысыммен, уақыт секундпен беріледі.
Концентрация өзгерісі DС=С2-С1 ал уақыт аралығы Dt=t2-t1 болса, жылдамдық:
 Өлшем бірлігі: моль/м 2 ∙с, моль/м2 ∙мин.
Өлшем бірлігі: моль/м 2 ∙с, моль/м2 ∙мин.
+, - әрекеттесуші заттар концентрациясы кеміп, реакция өнімі орта болғандықтан қойылады.
Әсер етуші массалар заңы н/се массалардың әрекеттесу заңы /МӘЗ/. Тепе-теңдік константасы /Кт-т /
МӘЗ заңы: Тұрақты температурада гомогенді химиялық реакция жылдамдығы стехиометриялық коэффициенттері дәрежесінде көрсетілген әрекеттесуші заттар концентрациясының көбейтіндісіне тура пропорционал.
I. Н2+Cl2=2HCl, V=k×CH2×CCl2
II. 2NO+O2=2NO2, V=k×C2NO×CO2
k–жылдамдық константасы, ол-заттың табиғатына және температураға тәуелді.
Химиялық реакция жылдамдығының температураға тәуелділігі Вант-Гофф ережесімен сипатталынады: температураны әр 100С-ға арттырғанда реакция жылдамдығы 2-4 есе өседі.

g - реакция жылдамдығының темп-лық коэфф-ті. Мәні 2-4 аралығында болады. Мысалы, g=2 болғанда, температураны 1000С-ға арттырғанда, химиялық реакция жылдамдығы 1024 рет өседі. Себебі:
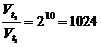
соқтығысу саны бұл жағдайда небәрі 1,2 рет өседі.
 2017-12-14
2017-12-14 3395
3395








