Тема № 11: Фізіологія рослин та біотехнологія
(2год.)
Мета: визначити особливості культур клітин та тканин рослин, як об’єктів біотехнології, охарактеризувати особливості збереження матеріалу в кріобанке, встановити особливості культивування генетично трансформованих рослин, сутність генетичної інженерії рослин та фармакогнозії, становлення та розвиток космічної фітофізіології.
Біотехнологія рослин і культури клітин, тканин. Кріобанк.
Культивування генетично трансформованих рослин. Біологічно активні речовини. Фармакогнозія.
Космічна фітофізіологія.
Біотехнологія рослин і культури клітин, тканин. Кріобанк.
Під методом культури тканин розуміють вирощування in vitro ізольованих клітин, їх структур, і тканин, органів в стерильних умовах на штучних поживних середовищах. В останні роки значно виросла зацікавленість вчених методом культури тканин. Це пояснюється підвищенням ролі клітинних культур у фундаментальних дослідженнях фізіології, цитології рослин, а також можливостями практичного використання клітинних технологій. Фундаментальні дослідження клітин і тканин in vitro є основою, яка дозволяє об'єднати різні рівні досліджень, починаючи з молекулярного та закінчуючи популяційним, що надзвичайно важливо для вивчення різних проблем біології рослинного організму в цілому. Цей метод біологічного моделювання дозволяє при інтерпретації одержаних даних виключати елементи корелятивних зв'язків, ефектів, характерних для цілого організму, Одним з основних принципів методу культури тканин є ступінь відтворення in vitro умов, близьких або ідентичних тим, в яких клітина знаходиться на материнській рослині in vivo.
Розробка основ методу має порівняно недавню історію. Габерландт (Haberlandt, 1902) вперше застосував цей метод на початку XX ст. для роботи з клітинами палісадної паренхіми. Він хотів виростити цю тканину з однієї клітини. Невдача, що спіткала автора, дещо затримала І роботу з рослинними організмами, але дослідження були продовжені на тваринних організмах.
Найважливішою умовою вирощування ізольованих рослинних тканин є поживні середовища необхідного складу. В Україні культуру ізольованих коренів широко використовував М.Г. Холодний ще в 1915 p., коли він за допомогою даного методу виявив біосинтез фітогормонів в кінчиках коренів, що стало основою для розробки його теорії тропізмів. Цей метод він використовував і пізніше.
В 30-і роки праці американського вченого Уайта та французького вченого Готре зумовили розробку власне сучасного методу культури рослинних тканин і органів. Уайт довів, що коренева меристема може рости тривалий час, якщо її пересаджувати на свіже середовище.
Культура клонів кінчиків кореня помідорів в його дослідах підтримувалася понад 30 років (Уайт, 1949). Заслугою Готре є те, що він вдосконалив склад поживних середовищ для вирощування недиференційованих тканин різних органів однодольних, дводольних та голонасінних рослин (Gautheret, 1959). Готре ввів у культуру різні калусні тканини у вигляді чистих клонів. Систематичні роботи з культури тканин в 40-х роках проводилися під керівництвом академіка М.О. Максимова. В Україні ці роботи було організовано в лабораторії Ф.Л. Калініна (Калінін, Сарнацька, Поліщук, 1980).
Відомо, що клітини різних тканин, органів, організмів функціонують іn vivo в специфічних метаболічних умовах. Це є науковою основою для розробки різних за складом поживних середовищ. Як відомо, тепер їх створено більше ста. Обов'язковими компонентами поживних середовищ є джерело мінерального живлення, певні макро- і мікроелементи, вуглеводи, біологічно активні речовини, які регулюють процеси поділу клітин га диференціацію їх. Мінеральний склад, обумовлений основними фізіологічними вимогами більшості тканин рослин, найбільш стабільний. Його модифікації досягаються внесенням різноманітних регуляторів росту. Особливо важлива регуляторна роль ауксинів та цитокінінів та їхнього співвідношення. На сучасному етапі цей метод дозволяє вирішити цілий ряд проблем фізіології та біотехнології рослин. Є також поживні середовища для вирощування культури тканин певних видів рослин, наприклад, орхідей.
Всі проблеми, які вирішуються методом культури тканин, ділять на три групи:
- перша вирішується на основі епігенетичної зміни генетичної інформації її поступової реалізації під впливом умов вирощування in vitro
- друга група проблем вирішується на основі зміни генетичної інформації шляхом мутагенезу. Вирішення проблем біології рослин на цій основі має виключне значення, бо воно пов'язане з одержанням нових штамів клітинних ліній, які мають надзвичайно великий теоретичний та прикладний, інтерес.
- третя група проблем вирішується методом культури тканин на основі перенесення та інтеграції генетичної інформації.
Метод культури тканин в останні роки все ширше застосовується для вивчення дії на рослини різних екстремальних факторів, взаємодії рослинної клітини з патогенними організмами. Даним методом вирішуються проблеми вивчення гетерозису, несумісності генетичної інформації двох геномів, стерильність гібридів при віддаленому схрещуванні, трансплантації клітин, їх частин, і навіть органів.
Наведені вище особливості методу культури рослинних клітин, тканин і органів дозволяють створити на їх основі різні технології. Серед них важливе місце займає одержання промисловим способом біологічно активних речовин рослинного походження.
Справа в тім, що культивовані клітини, як правило, зберігають здатність до синтезу вторинних сполук, властивих тому виду рослин, з яких вони взяті. Звичайно, можуть бути і відхилення в їхньому спектрі порівняно з вихідними рослинами. Цим методом можна одержати алкалоїди і глікозиди, сапоніни, фенольні сполуки, ефірні олії, фітогормони т. д.
Вихідним важливим принципом для цього є одержання культури клітин видів рослин з високою біосинтетичною здатністю. Шляхом мутагенезу і селекції виявляють найбільш продуктивні лінії. Цим методом вже одержано мутантні клітинні лінії раувольфії зміїної – продуцента індольних алкалоїдів, діоскореї дальтовидної, яка продукує діосгенін та ін. Ще більш перспективним є перенесення індивідуальних генів, які визначають вторинний метаболізм, в клітину-продуцент.
Другий важливий напрямок — використання тканинних культур для швидкого клонального мікророзмноження та оздоровлення рослин. В основі даної біотехнології є положення про можливу індукцію диференціювання і органогенезу, виникнення біологічної форми із однієї рослинної клітини, її здатності сформувати цілісну рослину (рис. 11.1). Клітина in vivo в складі тканини з певним структурним диференціюванням виконує вузьку специфічну функцію. Реалізація її морфогенетичних потенцій стримується in vivo факторами та умовами, які обумовлюються материнською рослиною. Якщо ж клітина ізольована із тканини і перебуває в штучно контрольованих умовах in vitro, то реалізується потенціальна можливість відновлення рослин із клітини або групи клітин. При цьому тотипотентність визначається вибірковою індукцією і репресією генетичної інформації.
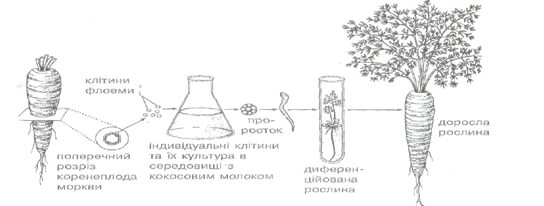
Рис. 11.1. Техніка виділення флоеми з Daucus carota та культивування тканин, вперше проведена Ф. Стюардом (F.S. Steward, 1950) в Корнельському університеті
Тотипотентні всі клітини, однак прояв даної властивості поки що виявляється в клітинах, які називають меристомоїдами. Меристомоїди – це морфогенєтично компетентні клітини, які відповідають на індуктори диференціювання і склад поживних середовищ для утворення пагонів, коренів, зародку. Морфологічно їх виявляють в калусних культурах у вигляді дрібних, ізодіаметричних, тонкостінних клітин з великим ядром, щільною цитоплазмою і в яких майже відсутні вакуолі. Так як саме із таких клітин складаються апікальні меристеми і клітини зародка, в тканинах, одержаних із цих органів, найлегше індукувати органогенез. Кількість меристомоїдних клітин, а звідси і експресія або пригнічення тотипотентності, значно залежить від умов, в яких перебуває клітина перед або в період індукції регенерації. Серед них найбільш важливими є освітлення, температура та вплив певних хімічних сполук. Розширення наших знань про фізико-хімічні і біологічні фактори, які визначають структурно-функціональний стан, клітини in vitro, дозволить успішно вирощувати і ті клітини, тканини, які поки ще важко піддаються культурі в контрольованих умовах (Калінін, Кушнір, Сарнацька, 1992).
Отже, регенерація із будь-яких клітин рослин можлива, якщо вдається трансформувати їх в меристомоїди створенням відповідних умов. Мікроклональне розмноження – це безстатеве вегетативне розмноження, в результаті якого одержують генетично ідентичні форми, що забезпечує збереження генетично однорідного посадкового матеріалу.
У виробничих умовах цей метод широко використовується, в тому числі і в Україні, наприклад, для оздоровлення та швидкого клонального розмноження на безвірусній основі в технології насінництва картоплі (Кучко,1992). Ще у 1934 р. П. Уайт виявив, що віруси відсутні у апексах коренів рослин, уражених вірусом тютюнової мозаїки. Відсутність вірусів в апексах розміром не більше 0,1 мм складає основу методу одержання безвірусних рослин з меристематичних клітин. Чому віруси відсутні саме у апексах? Як відомо, найбільш сприятливими для репродукції фітовірусів є тканини листків. Віруси нездатні автономно пересуватися по рослині, тому допускають симпластний або апопластний шлях їх міграції по рослинному організму. Клітини ж меристеми апексів дрібні, з тонкою целюлозною оболонкою, щільно зімкнені між собою, вони швидко діляться, тому в них недостатньо налагоджена система плазмодесм. Все це ускладнює апопластний і симпластний шлях міграції вірусів. Не виключені також фізіолого-генетичні механізми, які обумовлюють відсутність вірусів у меристемі апексів (наприклад, фітогормональне гальмування самореплікації вірусного геному). Однак метод мікроклонального оздоровлення стає більш надійним та ефективним при додатковій термообробці і хіміотерапії рослин. Наприклад, витримування насіння соняшника, пшениці при температурах 45-50 °С впродовж однієї години пригнічує вірусні інфекції, не порушуючи зародок. Цей метод дозволяє брати для клонального розмноження більші за розміром меристеми (0,3-0,8 мм), які значно краще виживають на поживних середовищах.
Останнім часом ведеться пошук антивірусних препаратів, які виробляються самими рослинами з метою використання їх в хіміотерапії при оздоровленні рослин. Позитивні результати одержані при використанні екстрактів лаванди, ромашки лікарської, шавлії та інших рослин.
Можливість застосувати методи клонального розмноження in vitro встановлено для більш ніж 400 видів рослин з 82 родин. Клональне мікророзмноження може бути використане для створення колекцій сортів і видів, збереження геномів зникаючих та рідкісних рослин. Переваги біотехнології мікроклонального розмноження рослин перед традиційним способом настільки очевидні, що безсумнівно забезпечать його подальше вдосконалення і розвиток.
Третій напрямок – використання методів клітинної і генної інженерії для генетичної зміни клітини та одержаної на її основі рослини, Для селекційного процесу технології клітинної і генної інженерії рослин мають величезні перспективи (Сидоров, 1990). Одержання рослин з відібраних в селективних умовах мутантних клітин також можливе завдяки унікальній властивості рослинної клітини – тотипотентності. Прийоми культури клітин та регенерації з них рослин уже сьогодні дозволяють реалізувати можливості клітинної селекції, зокрема, на стійкість до стресових факторів, гербіцидів, різних захворювань.
Особливого прогресу в даній галузі досягнуто завдяки розробці нової техніки культивування ізольованих протопластів клітин. Методологія клітинної селекції дозволяє проводити направлений відбір in vitro мутантних форм з певними господарсько-цінними ознаками. Подальше поглиблення наших знань фізіології клітин, що культивуються, процесів регенерації, їхніх молекулярних механізмів, особливостей структури ядерного та цитоплазматичного геномів рослин відкриють нові перспективи розвитку фізіології рослин та її впливу на біотехнологію рослин.
В умовах глобальної екологічної кризи збереження генофонду живих систем має першочергове значення і цю проблему включено в ряд міжнародних програм. Єдиним засобом необмежено тривалого збереження штамів клітин, тканин та мікроорганів є кріозбереження. Термін "кріозбереження" (cryopreservation) застосовують для позначення складного багатоетапного процесу, який дослідник проводить з метою необмежено довго зберегти стабільними живі клітини, тканини і органи в стані анабіозу (рис. 11.2).
Актуальність надійного збереження активно метаболічних клітин рослин в незмінному стані важко переоцінити, адже клітинні штами уже часто заміняють рослинну сировину на біотехно-логічних заводах, культура тканин дозволяє одержувати самоклональні варіанти – нове джерело генетичного різноманіття для селекції рослин, а ембріони і особливо апікальні меристеми забезпечують регенерацію рослин, які є точними копіями вихідних. Саме тому кріозбереження стає способом збереження генофонду не лише культури клітин, а й рослин з вегетативним розмноженням та інших. Цей процес досить простий лише для достатньо зневоднених об'єктів (пилок, ортодоксальне насіння), які можна прямо занурювати в рідкий азот з наступним розморожуванням на повітрі в звичайних умовах. Щодо оводнених клітин, тканин та органів рослин кріозбереження є вкрай екстремальним процесом і розпочинається, як правило, з етапу підготовки (спеціальне попереднє культивування), а закінчується рекультивуванням, яке забезпечує інтенсивний поділ клітин. Такий процес вважають успішним за умов відновлення росту культури.
Глибоке охолодження рідким азотом {-196 °С), зберігання та розморожування є стресовим фактором для клітини. Основне значення тут відіграє процес утворення кристалів льоду та зневоднення клітин, тому потрібна спеціальна підготовка клітин та меристем, застосування ефективних кріопротекторів та відповідна програма заморожування.
Найефективнішими кріопротекторами виступають диметилсульфоксид, гліцерин, пролін, цукроза. Оптимізація умов потрібна не лише для певного виду клітин, а навіть для певних штамів, Доведено, що рекультивовані після збереження клітинні культури женьшеню, діоскореї, моркви в основному ідентичні й придатні для біотехнології. Вони зберігають швидкість росту, морфогенетичний потенціал, а щодо меристем картоплі, то вже вдається регенерувати рослини, які дають врожаї.

Рис. 11.2. Основні етапи біотехнологічного процесу кріоконсервації генетичних ресурсів рослин
Успішного кріозбереження клітинних та тканинних культур in vitro досягнуто на сучасному етапі для 60-65 видів, з яких близько 30 – культури меристем.
Збереження генетичних ресурсів шляхом кріоконсервування меристем має багато переваг порівняно із іншими способами in vitro. Це пояснюється тим, що меристеми розвиваються безпосередньо в рослини, що забезпечує велику генетичну стабільність. До того ж вони легко витримують заморожування, бо мають дрібні клітини, в яких немає великих вакуолей.
На відміну від традиційних способів зберігання, кріоконсервація має істотні переваги, бо вона виключає можливість таких процесів, як втрата запасних речовин, нагромадження токсинів, розпад та інактивація ферментативних комплексів, самоокислення ліпідів, деградація функціональних та генетичних систем, а також ряд інших процесів, пов'язаних із старінням клітини.
Саме тому праці по збереженню генетичного різноманіття біосфери з допомогою кріоконсервації генетичних ресурсів рослин набувають інтенсивного розвитку.
Останнім часом у працях з клітинної селекції при культивуванні тканин використовують метод кріоконсервації недозрілих зародків рослин (ембріони). Потреба такої кріоконсервації зумовлена тим, що в стиглому насінні зародки досить стабільні і не піддаються мутагенним впливам. Тому у працях з генної інженерії мутагенні фактори використовують для впливу на незрілі ембріони. Метод кріоконсервації забезпечує тривале зберігання їх, а значить і використання клітинної селекції, що істотно прискорює селекційний процес.
Створення кріобанку клітин та меристем забезпечить зберігання існуючого генофонду, але в перспективі потрібні глибокі фізіолого-біохімічні дослідження з метою оптимізації глибокого заморожування для конкретних штамів, сортів і видів
Основні труднощі пов'язані із специфікою як самих рослинних клітин (великі розміри – до 2000 мкм, значна вакуолізація), так і їх популяцій in vitro. Клітини в таких популяціях генетично гетерогенні, асинхронні, частина їх виходить з мітотичного циклу в фазу Go. В кожній культурі клітини мають фізіологічні та морфологічні варіації, що впливає на кріостійкість їх, і тому далеко не всі клітини витримують кріозбереження. Фізіологічне та морфологічне різноманіття ще більше зростає у клітин різних штамів, тим більше у клітин різних видів.
У випадку меристематичних культур ситуація додатково ускладнюється. Кожна меристема є, по суті, мікроорганом розміром в середньому 500 мкм(в якому поряд з дрібними клітинами власне меристем, що діляться, наявні клітини Інших тканин, що знаходяться на різних стадіях диференціювання, часто витягнуті та вакуолізовані неоднаковою мірою. Кріостійкість таких клітин набагато менша, ніж власне меристематичних.
Взаємодія клітин, зокрема детермінованих в примордії і власне меристематичних, має вирішальне значення для всієї меристеми. Якщо взаємодія в процесі кріоконсервації збереглась, тобто відповідні клітини вижили, то меристема регенерує рослину, якщо ж ні, то одержується неорганізований ріст, тобто утворюється калус, з нього теж можна регенерувати рослину, але такий шлях небажаний для кріозбереження меристем, бо при регенерації через калус немає впевненості в абсолютно точному відтворенні вихідного генотипу. Тому потрібні спеціальні дослідження регенерованих рослин, щоб встановити ідентичність їх до вихідних.
Отже, завдання кріозбереження апікальних меристем не зводиться до збереження лише власне меристематичних клітин. Головна мішень кріопошкоджень – плазмалема і її зміни пов'язані з порушенням неперервності структури її ліпідного шару. Тому в процесі кріоконсервації поряд з природними процесами кріостійкості рослинних клітин використовується весь арсенал підготовки та штучного кріозахисту. Саме клітини, тканини та апікальні меристеми при їхній культурі in vitro дозволяють зробити кріозбереження універсальним способом збереження генофонду, поширивши його на види рослин з рекальцитратним насінням і на види, які розмножуються лише вегетативно.
 2017-12-14
2017-12-14 2246
2246