Цель работы: изучение кинетики реакции взаимодействия полиэфира с диизоцианатом с помощью метода ИК-спектроскопии.
| Реактивы: Полиэфир с концевыми гидрокисльными группами, 2,4-толуилендиизоцианат | Посуда и приборы: ИК-спектрометр с набором кювет и окон CaF2, термостат, бюксы или колбы объемом 100 см3, стеклянные палочки. |
ИК-спектроскопическое исследование кинетики образования полиуретанов основано на исчезновении на ИК-спектре колебаний изоцианатной группы -NCO в области 2270 см-1. Для этого проводится исследование реакционной смеси путем отбора проб и снятии их ИК-спектра через определенные промежутки времени.
Методика работы: Полиэфир (содержание ОН-групп 2,1 % масс.) предварительно высушивают под вакуумом при остаточном давлении не выше 1,33 кПа (10 мм рт.ст.) и температуре 90-100 0С в течение 2 часов. Затем полиэфир охлаждается до комнатной температуры. Предварительно производится нагрев термостата с кюветами до температур (для разных опытов) 80, 90, 100 оС. После этого к 20 г полиэфира добавляется толуилендиизоцианат в количестве 4,5 г (соотношение NCO:OH=2:1) и тщательно перемешивается. Полученная смесь стеклянной палочкой 2-3 каплями помещается на окно из CaF2. Далее на стекло помещается спейсер (прокладка) толщиной 0,03 мм и зажимается вторым окном. После этого оба окна зажимаются резиновыми прокладками в кювете. Производится съемка ИК-спектра на ИК-спектрометре. для этого включается прибор, кювета помещается в рабочую область спектрометра и производится запуск записи. Далее кювета помещается в термостат. Через определенные промежутки времени (20, 40, 60, 90, 120, 160 минут) производится доставание кюветы из термостата и запись ИК-спектра.
Обработка результатов: на рисунке 2 приведен пример ИК-спектра реакции взаимодействия полиэфира с толуилендиизоцианатом.
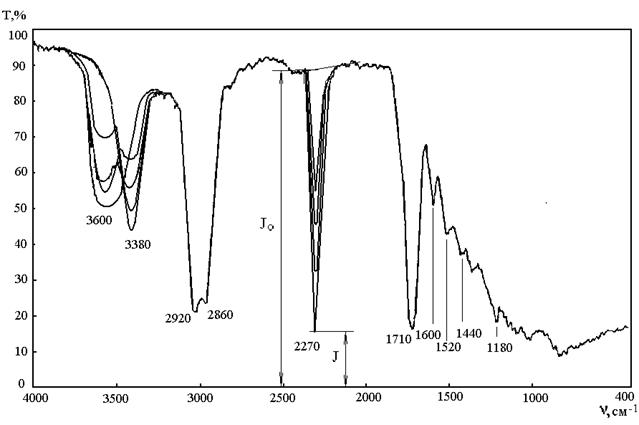
Рисунок 2 – ИК-спектр взаимодействия полиэфира с ТДИ. I0 – интенсивность падающего монохроматического излучения, I - интенсивность прошедшего монохроматического излучения.
Для исследований кинетики процесс пользуются законом Бугера-Ламберта-Бера в следующей форме:
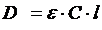
где D – оптическая плотность; ε – коэффициент молярного поглощения; С – концентрация, моль/л; l – толщина слоя вещества, см.
Оптическая плотность может быть также определена из спектра как:
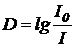
где I0 – интенсивность падающего монохроматического излучения, I - интенсивность прошедшего монохроматического излучения.
Задание: рассчитать начальную концентрацию изоцианатных групп и гидроксильных групп (в моль/л) в смеси, учитывая, что плотность полиэфира ρп=1,22 г/см3, плотность ТДИ ρТДИ=1,217 г/см3, соотношение NCO:OH=2:1.
Текущую концентрацию NCO-групп рассчитываем используя закон Бугера-Ламберта-Бера для различных концентраций:
для начальной концентрации:
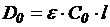
для текущей концентрации:
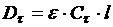
поскольку ε и l остаются постоянными, то для расчета текущей концентрации используем следующую формулу:

Таким образом, полученные экспериментальные данные сводим в таблицу 4.
Таблица 4 – Экспериментальные данные реакции взаимодействия полиэфира и толуилендиизоцианата.
| № | Dt, мин | I0 | I | D=lgI0/I | СNCO, моль/л | lnC0/Cτ | 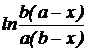 * *
|
* a и b – начальные концентрации гидроксильных и изоцианатных групп; х – количество прореагировавших изоцианатных групп к моменту времени τ.
Используя полученные экспериментальные данные необходимо определить порядок реакции, константу скорости реакции, энергию активации.
Для определения порядка реакции использовать графический метод. Для этого строятся графики зависимости lnC0/Cτ=f(τ) (проверяется первый порядок реакции) и  (проверяется второй порядок реакции при неравных начальных концентрациях реагирующих веществ).
(проверяется второй порядок реакции при неравных начальных концентрациях реагирующих веществ).
После определения порядка реакции из соответствующего графика определяется константа скорости:
- для реакции 1-го порядка как тангенс угла наклона (tgα);
- для реакции 2-го порядка соответственно tgα /(а-b).
Для определения энергии активации используется следующая математическую зависимость:

где R – универсальная газовая постоянная; Т1, Т2 – температуры, К; k1, k2 – соответствующие константы скорости реакции.
Лабораторная работа № 6
 2018-01-08
2018-01-08 994
994








