Цель работы: изучение кинетики сложной реакции с определением константы скорости и энергии активации с использованием метода спектрофотометрии.
Реакция йодирования ацетона, которую можно описать следующей краткой схемой идёт с заметной скоростью как в кислой, так и щелочной среде.
CH3COCH3 + I2 CH3COCH2I + HI
Механизм реакции в этих средах различен. Для случая протекания реакции в водных растворах сильных кислот её схема может быть записана как следующая последовательность стадий:
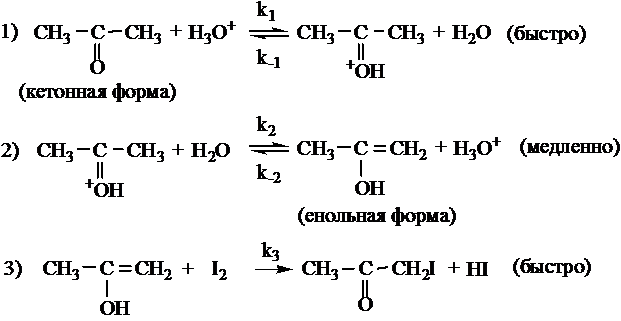
В первых двух стадиях кетон переходит в енол. Кислота ускоряет как прямую, так и обратную реакции кето-енольного перехода. В отсутствие йода в системе устанавливается равновесие между двумя формами. При введении в раствор йода происходит взаимодействие I2 с енольной формой (третья стадия), в результате чего енол выводится из реакции. Таким образом, третья стадия состоит в связывании енольной формы йодом. Третья стадия идёт быстро и не влияет на общую скорость процесса.
Было доказано, что эффективная константа скорости kэфф не зависит от концентрации йода и не изменяется при замене йода на бром. Вместе с тем скорость реакции прямо пропорциональна концентрации ионов H3O+. Это отвечает механизму, в котором общая скорость реакции определяется процессом енолизации ацетона, причём стадия протонирования ацетона является быстрой равновесной, а стадия образования енольной формы – медленной и лимитирующей. В этом случае скорость реакции равна:
n=k2[CH3C(OH)CH3+][H2O]
Учитывая что, константа равновесия протонирования ацетона равна:
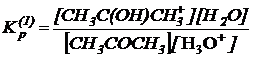
выражение для скорости реакции нетрудно привести к виду:
n= k2Кр(1)[CH3COCH3][H3O+]
В этом случае эффективная константа скорости равна кетонная форма:
kэфф= k2Кр(1)
Кинетические исследования проводят спектрофотометрическим методом. Для измерений можно использовать длину волны от λ =350 нм максимум в спектре поглощения) до λ =410 нм (склон пика поглощения).
Йодирование ацетона является примером медленно идущей реакции. Хотя концентрация йода не входит в кинетическое уравнение, кинетику удобно исследовать именно по убыли йода, применяя спектрофотометрический метод. Обозначим начальные концентрации ацетона и ионов водорода CA и CH соответственно. После замены эффективной константы на опытную (kоп) и принимая, что концентрация йода значительно меньше, чем начальные концентрации остальных реагентов скорость реакции можем записать:
n= kоп·CA·CH,
откуда
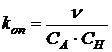 .
.
Поскольку в ходе реакции происходит расходование йода, то скорость реакции удобно измерять по изменению оптической плотности D раствора на длине волны поглощения йода:
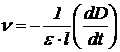 ,
,
где ε – экстинкция йода, l – толщина кюветы. Следовательно, выражение для опытной константы можно переписать в виде:
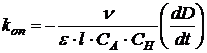 ю
ю
Таким образом, для определения kоп нужно изучить зависимость D от t и определить угловой коэффициент dD/dt. Кроме того, нужно знать начальные концентрации ацетона и кислоты, а также экстинкцию йода на выбранной длине волны.
| Материалы: ацетон, йод, калий йодистый, 1 н. раствор соляной кислоты | Посуда и приборы: мерные колбы: на 200 мл (1 шт.), на 50 мл (4 шт.), на 100 мл (6 шт.); пипетки на 1, 5 и 10 мл; спектрофотометр, кварцевая кювета толщиной 1 см; секундомер. |
Ход работы:
Готовят два исходных раствора:
– раствор А – раствор йода с концентрацией 1,0·10–3 М (готовят студенты);
– раствор B – раствор соляной кислоты концентрацией 1,0 н. (приготовлен лаборантом).
Раствор А готовят в мерной колбе на 200 мл. Точно рассчитанную навеску йода переносят в колбу и растворяют в небольшом количестве 10 %-го раствора KI (30 % от объёма колбы), а затем приливают воду, доводя объём до 200 мл.
Из раствора A точным разбавлением водой в колбах на 50 мл готовят четыре рабочих растворов йода с концентрациями:
| Номер раствора | Р1 | Р2 | Р3 | Р4 |
| Конц. йода, М | 0,5·10–4 | 0,75·10–4 | 1,0·10–4 | 1,5·10–4 |
Эти растворы нужны для проверки закона Бугера – Ламберта – Бера. Для проведения кинетических опытов готовят шесть растворов.
| Номер опыта | Концентрация ацетона, M | Концентрация HCl, M | Концентрация йода, M |
| 0,1 | 0,1 | 1,0·10–4 | |
| 0,05 | 0,1 | 1,0·10–4 | |
| 0,1 | 0,05 | 1,0·10–4 | |
| 0,1 | 0,05 | 0,7·10–4 | |
| 0,15 | 0,1 | 1,0·10–4 | |
| 0,1 | 0,15 | 1,0·10–4 |
Эти растворы готовят в колбах на 100 мл в такой последовательности:
– заполняют мерные колбы водой примерно на 3/4, не доводя её уровень до метки;
– пипеткой добавляют в колбы рассчитанные количества растворов A и B (например, для опыта № 1 – по 10 мл).
Записывают спектры растворов Р1–Р4 и раствора А. Выбирают рабочую длину волны таким образом, чтобы оптическая плотность растворов не превышала 1,0 (рекомендуемое значение λ =410 нм). Строят график зависимости оптической плотности D от λ, определяют коэффициент экстинкции на рабочей длине волны.
Непосредственно перед началом каждого кинетического опыта:
– приливают в колбу рассчитанное количество чистого ацетона (плотность при 20 0С равна 0,7908 г/см3, молекулярная масса 58 г/моль), быстро перемешивают раствор, включают секундомер;
– доливают колбу водой до метки, снова перемешивают раствор;
– ополаскивают и заполняют кювету этим раствором, устанавливают её в держатель спектрофотометра и начинают измерение оптической плотности в зависимости от времени на длине волны 410 нм. Реакцию ведут до обесцвечивания раствора: D < 0,05.
После проведения кинетических опытов строят графики зависимости D от t и определяют величину (dD/dt). Рассчитывают во всех опытах значения kоп. Сводят данные в таблицу и делают выводы о зависимости скорости реакции от концентрации ацетона, кислоты и йода, а также о корректности выбранного механизма. Определяют порядки реакции по ацетону, кислоте и йоду.
Для определения энергии активации Eакт и предэкспоненциального множителя k0 реакции йодирования ацетона проводят опыты при двух или трёх температурах в термостатированных кюветах. По найденным значениям kоп при разных температурах рассчитывают по уравнению Аррениуса значения Eакт и k0.
Отчёт о работе должен содержать:
– сведения о начальной концентрации реагентов и температуре проведения реакции;
– результаты проверки закона Бугера-Ламберта-Бера, значение рабочей длины волны и коэффициента экстинкции;
– кинетические кривые (зависимость оптической плотности от времени);
– графики, по которым определяли порядок реакции по реагентам и энергию активации;
– найденные значения порядков реакции по реагентам, энергии активации Eакт и предэкспоненциального множителя k0.
Лабораторная работа №4
 2018-01-08
2018-01-08 5411
5411
