Цель работы: изучить кинетику линейной поликонденсации диэтиленгликоля и адипиновой кислоты и оценить энергию активации процесса.
| Реактивы: диэтиленгликоль, адипиновая кислота, п-толуолсульфокислота (катализатор), ацетон, фенолфталеин или тимоловый синий, 0,1 н спиртовый раствор КОН. | Посуда и приборы: четырехгорлая колба с механической мешалкой, трубка для ввода инертного газа, термометр на 200 °С, обратный холодильник, баня с силиконовой жидкостью, химические стаканы или колбы Эрленмейера для титрования на 100 мл, резиновая груша со стеклянным капилляром длиной 20 см и внутренним диаметром 6-8 мм. |
Методика работы:
В реакционную колбу (рисунок 1) помещают 19 мл (0,2 моля) диэтиленгликоля (ДЭГ), 29,2 г (0,2 моля) адипиновой кислоты (АК) и 0,304 г (1,6 моля, т.е. 0,2 % (мол.) от смеси) п-толуолсульфокислоты. Поликонденсацию проводят при температуре 150, 160 и 170 °С. Колбу помещают в предварительно нагретую баню с силиконовой жидкостью. Перед самым плавлением твердой массы в один из отводов колбы через трубку подают ток инертного газа. Отвод, в который вставлен термометр, служит также и для отбора проб.
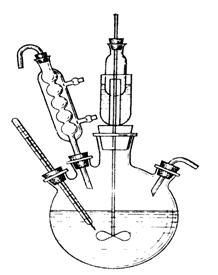 Рисунок 1– Прибор для поликонденсации АК и ДЭГ. Рисунок 1– Прибор для поликонденсации АК и ДЭГ. | Пробы отбирают через определенные промежутки времени (1-я проба через 30, и далее каждые 15-20 минут после начала реакции) в течение 2-2,5 часов. Во время отбора проб мешалку останавливают. В стеклянный капилляр набирают примерно 1 см3 реакционной смеси и быстро выдувают ее в предварительно взвешенный с точностью до 0,001 г стакан (или колбу) емкостью 100 см3. |
Далее в колбу заливается 25 мл ацетона и растворение навески. После этого производится определение кислотного числа путем титрования раствора реакционной смеси 0,1 н. спиртовым раствором КОН в присутствии фенолфталеина (или тимолового синего) до появления розовой окраски фенолфталеина (или синей окраски тимолового синего), сохраняющихся в течение 30 с. Одновременно проводят контрольный опыт в тех же условиях. Кислотное число (К.Ч.) в мг КОН на грамм полиэфира вычисляют по формуле
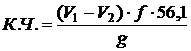 ,
,
где V1 – объем раствора гидроокиси калия, израсходованный на титрование анализируемого полиэфира, см3;
V2 – объем раствора гидроокиси калия, израсходованный на титрование в контрольном опыте, см3;
f – фактическая молярная концентрация эквивалента (фактическая нормальность) раствора гидроксида калия, моль/дм3;
56,1 – эквивалентная масса гидроксида калия, г/моль;
g - масса навески полиэфира, г.
Степень завершенности реакции определяют по следующей формуле:
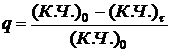
где (К.Ч.)0 – кислотное число соответствующее начальному моменту реакции, мг КОН/г;
(К.Ч.)τ – кислотное число соответствующее моменту времени τ, мгКОН/г.
Кислотное число, соответствующее началу реакции (τ=0), рассчитывается по составу исходной смеси по следующей формуле (для эквимолярных соотношений компонентов):
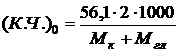
где Мк – молекулярная масса кислоты;
Мгл – молекулярная масса гликоля.
По величинам q рассчитывают среднюю степень поликонденсации олигоэфира используя уравнение Карозерса для эквимолярных соотношений компонентов:

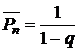
Сравнивая значения найденного и теоретического К.Ч., судят о содержании полиэфира в полученном продукте и степени конверсии мономеров. Его значение может быть использовано для расчета молекулярной массы синтезированного полиэфира.
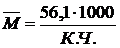
Полученные данные заносят в таблицу 3.
Таблица 3
| № | Время от начала реакции, мин | К.Ч., мгКОН/г | Степень завершения, q | Средняя степень поликонденсации, 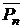 | Средняя молекулярная масса,  |
Задание:
1) Написать схемы протекающих в процессе поликонденсации реакций.
2) Построить кинетические кривые в координатах «1/(1-q) – время реакции». Рассчитать по тангенсу угла наклона прямых константы скорости реакции при разных температурах. Построить график зависимости lnk=f(1/T), где Т – абсолютная температура. Определить энергию активации через тангенс угла наклона полученной прямой (Е = R · tgα, кДж/моль).
Лабораторная работа №5
 2018-01-08
2018-01-08 1040
1040








