Приготовить 200г 5%-го раствора карбоната натрия из кристаллической соды Na2CO3 ∙10H2O и воды.
Вычислить какая масса Na2CO3 ∙10H2O требуется для приготовления 200г 5%-го раствора в расчете на безводную соль Na2CO3, а затем на Na2CO3 ∙10H2O.
Отвесить эту массу измельченной соды в предварительно взвешенном стаканчике на весах с точностью до 0,01 г.
Рассчитать, какой объем воды необходим для растворения взятой навески. Отмерить мерным цилиндром этот объем воды. Вылить воду в стакан и растворить в ней отвешенную соль, измерить температуру приготовленного раствора. Вылить раствор в сухой (или ополоснутый этим раствором) высокий узкий цилиндр и определить с помощью ареометра его плотность. По найденной плотности, пользуясь таблицей 2(см приложение), определить ω (%) Na2CO3 в растворе. Если в таблице нет этой величины плотности, а есть немного меньшая или большая, то использовать метод интерполяции по следующей формуле:
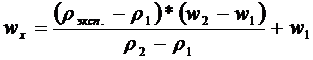 ,
,
где rэксп. – экспериментально определенная плотность, которой соответствует концентрация wx в %, r1 – плотность раствора ближайшего меньшего значения концентрации (w1), r2 – плотность раствора ближайшего большего значения концентрации (w2). Сравнить полученную величину с заданной.
Рассчитать молярную и нормальную концентрации приготовленного раствора.
Б) из концентрированного раствора и воды
1. Приготовить 250 г 10%-ного раствора кислоты из имеющегося в лаборатории раствора.
Определить ареометром плотность раствора серной кислоты, имеющейся в лаборатории.
Найти в таблице ω (%) раствора кислоты, отвечающую данной плотности.
Рассчитать, какую массу этого раствора кислоты нужно взять для приготовления 250 г 10%-ного раствора, и затем пересчитать полученную величину навески на объем.
Рассчитать нужный объем воды, отмерить его мерным цилиндром и влить в стакан.
Отмерить мерным цилиндром рассчитанный объем раствора кислоты, влить тонкой струей при перемешивании его в воду и тщательно перемешать раствор.
Охладив раствор, определить ω (%) полученного раствора и проверить точность выполнения опыта.
Вычислить молярную и молярную концентрации эквивалента полученного раствора.
 2018-01-08
2018-01-08 550
550








