Методичні вказівки
До виконання практичних робіт з дисципліни
«Фізична хімія та аналітичний контроль»
для студентів спеціальності 5.05040103 «Виробництво сталі і феросплавів»
спеціалізації: 5.05040103.01 «Виробництво сталі у конверторах і мартенівських печах», 5.05040103.02 «Електрометалургія сталі і феросплавів»
Укладач Ю.О. Кущ
викладач ІІ категорії
Рецензент Л.Л. Кошутіна.
викладач вищої кваліфікаційної
категорії, викладач - методист
Розглянуто і схвалено на засіданні
Циклової комісії металургійних дисциплін
Протокол № ____
від “ ____ ” ___ _________ 2011 р.
Голова циклової комісії О.В. Таран
Запоріжжя 2011
Методичні рекомендації до виконання практичних робіт з дисципліни «Фізична хімія та аналітичний контроль» для студентів денної та заочної форм навчання спеціальності 5.05040103
«Виробництво сталі і феросплавів» спеціалізації: 5.05040103.01 «Виробництво сталі у конверторах і мартенівських печах», 5.05040103.02 «Електрометалургія сталі і феросплавів»
. Кущ Ю.О.. – Запоріжжя, ЗМК ЗДІА, 2011 р.
|
|
|
Розглянуто і схвалено на засіданні
циклової комісії металургійних дисциплін
Протокол № ____
від “ ____ ” ___ _________ 2011 р.
Голова циклової комісії О.В. Таран
Рецензент: викладач вищої кваліфікаційної
категорії, викладач - методист Л.Л. Кошутіна
Зміст
Вступ......................................................................................................................4
1. Практична робота №1 “Розрахунки за основними газовими законами”......5
2. Практична робота №2 “Розрахунок теплоємкості, внутрішньої енергії,
роботи”....................................................................................................................8
3. Практична робота №3 “Розрахунок теплового ефекту хімічної реакції” ….12
4. Практична робота №4 “Розрахунок термодинамічного потенціалу”.......….16
5. Практична робота №5 “Розрахунок ентропії”..................................................19
6. Практична №6 “Розрахунок швидкості хімічної реакції, а також вивчення впливу температури на швидкість хімічної реакції”.......................................23
7. Практична робота №7 “Розрахунок константи хімічної рівноваги, а також вивчення впливу температури, тиску, концентрації на хімічну рівновагу”..28
8. Практична робота №8 “Розрахунок фазової рівноваги”..................................32
9. Практична робота №9 “Розрахунок кількості речовини для приготування розчинів заданої нормальної, молярної, процентної концентрації”...............36
10. Практична робота №10 “Розрахунок осмотичного тиску розчинів”.............42
Література.................................................................................................................46
Вступ
Діючою програмою з дисципліни “Фізична хімії та аналітичний контроль” передбачається проведення практичних робіт з розділів предмета.
|
|
|
Основна дидактична мета практичної роботи – розширення і деталізація наукових знань, отриманих студентами на лекціях та в процесі самостійної роботи, спрямованих на підвищення рівня засвоєння навчального матеріалу.
Тематика і зміст практичних робіт із переліком рекомендованої літератури заздалегідь доводяться до відома студентів.
Перелік тем практичних робіт визначається робочою навчальною програмою дисципліни.
Готуючись до практичної роботи, студент повинен повторити теоретичний матеріал за даною темою, ознайомитись з порядком виконання практичної роботи. При виконанні практичної роботи необхідно розглянути приклад. Варіанти індивідуальних завдань співпадають з номерами прізвища студента в класному журналі.
Робота повинна починатися з умови завдання. При виконані роботи треба привести короткі пояснення до розрахунків.
Готуючись до заліку, студент повинен повторити теоретичний матеріал, відповісти на контрольні запитання з практичної роботи.
Практична робота № 1
Тема роботи – Загальні газові закони.
Мета роботи – навчитися вести розрахунки за основними газовими законами.
Теоретичне обґрунтування
Для виконання практичної роботи студенти повинні знати газові закони, а саме:
1. Менделєєва – Клапейрона, що встановлює зв’язок між тиском, об’ємом і температурою газів

2. Закон Бойля – Маріотта: при Т – const
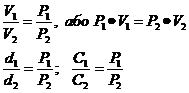
V1 – об’єм газу під тиском Р1;
V2 – об’єм газу під тиском Р2;
d1 – щільність газу під тиском Р1;
d2 – щільність газу під тиском Р2;
С1 – концентрація газу під тиском Р1;
С2 – концентрація газу під тиском Р2.
3. Закон Гей – Люсака – характеризує залежність об’єму газу (V) від температури (Т) при сталому тиску
 ,
,
як наслідок:

ρ1 – щільність газу при температурі Т1;
ρ2 – щільність газу при температурі Т2.
4. Закон Шарля – характеризує залежність між тиском (Р) газу і температурою (Т) при сталому об’ємі (V)

Приклад.
Чому дорівнює маса гідрогену, що займає при нормальних умовах об’єм 4 л? Який об’єм займає ця кількість газу при 27 0С і 150 кПА?
Варіант вирішення:
1) знаходимо масу газу: 2г гідрогену займає об’єм 22,4л
х г гідрогену – 4л
х = 0,357 г.
2) Обчислюємо об’єм газу при 27 0С і 150 кПА:
27 0С + 273 = 300 0К

Відповідь: маса 4л Н2 (н.у.) дорівнює 0,357г. Об’єм цієї маси газу при 27 0С і 150 кПА становить 2,97л.
Порядок виконання роботи
1. Викладач проводить експрес опитування студентів за темою практичної роботи з метою виявлення готовності студента до виконання роботи.
2. Видача індивідуальних завдань для практичної роботи.
3. Студенти самостійно працюють над розрахунками, складають звіти, роблять висновки з роботи.
4. Захист практичної роботи має бути в усній або в письмовій формі, як спланує заняття викладач.
Контрольні запитання:
1. Запишіть математичну формулу Менделєєва – Клапейрона.
2. Сформулюйте закон Бойля – Маріотта.
3. Сформулюйте закон Гей – Люссака.
4. Сформулюйте закон Шарля.
5. Сформулюйте закон Авогадро.
6. Намалюйте графік ізохори, ізобари, ізотерми.
Варіанти індивідуальних завдань
до практичної роботи №1
1. Газ під тиском 1,2*105 н/м2 займає об'єм 4,5 л. Яким буде тиск, якщо, не змінюючи температури, збільшити об'єм до 5,5 л?
2. У сталевому балоні місткістю 1 л знаходиться кисень під тиском 1,415* 107 н/м2 при 0°С. Який об'єм (м3) займе та ж кількість газу за нормальних умов?
3. За нормальних умов щільність двоокису вуглецю 1,977 кг/м3. Яким тиском потрібно стиснути газ, щоб щільність його при 0 С досягала 10 кг/м3?
4. Маса 1м3 азоту при 10°С і тиску 9,86*104н/м2 дорівнює 1,175 кг Яка маса цього ж об'єму азоту під тиском 1,092*10 н/м2 при тій же температурі?
5. Азот в кількості 56г під тиском 4,052*105н/м2 займає об'єм 10л. Який потрібно застосувати тиск, щоб концентрація азоту стала 0,3моль/л при постійній температурі.
|
|
|
6. При 37°С об'єм газу дорівнює 0,50м3. Який об'єм займе газ при 100°С, якщо тиск залишиться постійним?
7. При 18°С тиск в балоні з азотом дорівнює 1,621* 106н/м2. При якій температурі тиск зростає в 2 рази?
8. Щільність Неону при н.у. дорівнює 0,90°кг/м3. Розрахувати щільність]Неону, приймаючи його за ідеальний газ, при 27°С і тому жтискові.
9.При н.у. концентрація метану дорівнює 0,0447 кмоль/м3. Обчислити при якій температурі і нормальному тиску маса 10м3 метану буде 8 кг?
10.Обчислити об'єм димових газів при нормальному тиску, якщо їх об'єм при тиску 9,888*10 н/м і постійній температурі дорівнює 10м.
11. При н.у.1кг повітря займає об'єм 0,773м3. Який буде об'єм цього ж повітря при 9320н/м2 і 0°С.
12. Об'єм азоту під тиском 2,25*105н/м2 дорівнює 125л. Під яким тиском об'єм стане 10м3?Температура газу постійна.
13. Тиск газу, що займає об'єм 2,6м, дорівнює 1,5*10 н/м2. Яким стане тиск, якщо, не змінюючи температури, стиснути газ до 500л?
14. У сталевому балоні місткістю 12л знаходиться кисень підтиском 1,418*107н/м2 і при 0°С. Який об'єм займе ця кількість кисню (м3) за нормальних умов?
15. За нормальних умов щільність ацетилену 1,16 кг/м3. Визначити щільність цього ж газу під тиском 1,25Ін/м і 0 С.
16.За нормальних умов щільність азоту 1,251*10 кг/м. Який тиск необхідно прикласти, щоб щільність цього газу при 0°С стала 5 кг/м3?
17. Під яким тиском знаходиться кисень, якщо щільність його при 0°С дорівнює 6,242 кг/м? Щільність кисню при н.у. 1,429кг/м.
18. При 0°С і 4,558*105н/м2 щільність азоту 5,625кг/м3. Яка щільність азоту при 0°С 1,165*106н/м2?
19. Маса 1м3 повітря при н.у. 1,293кг. Яка маса цього ж об'єму повітря при тиску 435 н/м2 і 0°С.
20.Маса 1м3 сухого коксового газу при н.у. 0,480 кг. Яка маса цього ж об'єму газу під тиском 93300н/м2 і при 0°С?
21. Маса 1м3 сухого доменного газу при н.у. 1,24 кг. Яка маса цього ж об'єму газу при 0°С і 1,566*105н/м2?
22. Під тиском 6,078* 105н/м2 2,4 кг кисню займає об'єм Зм3. Обчислити тиск при якому концентрація кисню стала 0,1 кмоль/м3. Температура постійна.
23. Під тиском 101325 н/м2 і при 0°С концентрації метану 0,04472 кмоль/м3. Під яким тиском маса 4м3 метану при 0°С складе 32кг?
24. При 17°С газ займає об'єм 680м3. Який об'єм займе цей же газ при 100°С, якщо тиск залишиться незмінним?
|
|
|
25. У скільки разів збільшиться об'єм газу при постійному тиску, якщо підвищити температуру від 0 до 280°С?
Рекомендована література:
1. Гамеева О.С. Физическая и колоидная химия.М. Высшая школа. 1969.408 с. § 21
Практична робота № 2
Тема роботи – Теплоємкість речовин.
Мета роботи – навчитися вести розрахунки теплоємності, яка є важливим параметром у розрахунках теплових балансів виробничих процесів.
Теоретичне обґрунтування
Теплоємкість – здібність речовин поглинати при нагріванні теплоту. У різних речовин вона різна. Оцінюється теплоємкість кількістю теплоти (кДж, Дж), що поглинається речовиною при нагріванні на 10С.
Питова теплоємкість(Сп) – це кількість теплоти, що необхідно для нагрівання 1кг речовини на 10С (кДж/кг х град, дж/кг х град).
Мольна теплоємкість(См) – кількість теплоти, необхідне для нагрівання 1 моля речовини на 10С (КДж/кмоль х град, Дж/моль х град).
У технічній термодинаміці використовують також об’ємну теплоємкість(Соб).
Об’ємна теплоємкість – кількість тепла, необхідне для нагрівання 1м3 газу на 10С.
Мольна теплоємкість:
1. См = Сп * Мr, Мr –молярна маса речовини
2. Соб = См /22,4; Соб = Сп * ρ
ρ – питома вага газу кг/м3
3. Сv – ізохорна теплоємкість
Cp – ізобарна теплоємкість
Cp - Сv = R
R- універсальна газова стала; R=8,313 Дж/град
4. Дійсна теплоємкість
Сдійсна = ао + а1 * Т + а2 * Т2 +...
ао , а1 , а2 – коефіцієнти, які знаходять дослідним шляхом.
Т- температура, оК, при якій знаходять дійсну теплоємкість.
5. Середня теплоємкість в інтервалі температур
Сср = ао + а1 * (Т2+Т1)/2+ a2(T22+T2*T1+T12)/3
6. Теплоємкість суміщав, якщо між ними немає хімічної взаємодії _
Сп=(1/100)*(а*С1+b*C2+…)
a, b – кількість речовин в суміші (%)
С1, С2 – питомі теплоємкості складових суміші
7. Теплоємкість сплавів
С=Σ *n*Ci
n – доля елементу, що входить до сплаву
Сi – теплоємкість даного елементу в сплаві
 2018-01-08
2018-01-08 1182
1182