1. Обчислити стандартну зміну ізобарного потенціалу Δ G для реакції:

Значення Δ G реагуючих речовин:

2. Розрахувати к.п.д. ідеальної машини Карно, що отримує пар при 1400С і випускає його при 1500С.
3. Визначити зміну ізобарно – ізотермічного потенціалу для реакції:
N2 + 2H2O (ж) = NH4NO2 + ΔG0
і дати висновок про можливість її протікання при стандартних

4. Обчислити ізобарно-ізотермічний потенціал реакції і дати висновок про можливість її протікання за стандартних умов:
3C2H2 = C6H6 + ΔG
значення реагуючих речовин:

5. Ідеальної машини Карно, що працює в інтервалі між 350 і 500С, дає 33,52 кДж за робочий цикл. Яка кількість теплоти надається машині і віддається за цей же цикл?
6. Визначити зміну ізобарно-ізотермічного потенціалу за стандартних умов для реакції:
Fe3O4 + CO = 3FeO + CO2
Питання про моливість самочинного протікання реакції:

7. Ідеальна машина Карно, отримує пару при 2300С і випускає його при 480С. Визначити к.п.д. машини.
8. Обчислити ізобарно-ізотермічний потенціал реакції і дати висновок про можливість її протікання за стандартних умов:
CO2 (г) + 2H2O (ж) = CH4 (г) + 2О2 (г)
і вирішити питання про можливість самочинного протікання її за вказаних умов:

9. Ідеальна машина Карно між 927 і 1270С виробляє 103 кДж роботи за цикл. Визначити кількість теплоти, що надається машині, і що віддається нею за цей же цикл?
10. Ідеальна машина Карно, отримує пару при 2600С і випускає його при 520С. Визначити к.п.д. машини.
11. Дати висновок про можливість протікання реакції, визначити зміну ізобарно-ізотермічного потенціалу:


12. Чи можлива реакція C6H6 = 3C2H2, якщо

13. Ідеальна машина Карно, отримує пару при 2500С і випускає його при 400С. Визначити к.п.д. машини.
1. У якому напрямі може протікати реакція крекінга циклогексану при 7270С C6H12 = 3C2H4, якщо при даній температурі
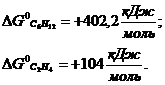
2. З’ясувати можливість отримання металевого кадмію з сульфату кадмію (ІІ), відновленням оксидом вуглецю за реакцією:
2CdS (кр) + 2CO(г) → СО2 (г) + CS2 (г) + 2Cd
Якщо відомо:

Рекомендована література:
1. Гамеева О.С. Физическая и колоидная химия.М. Высшая школа. 1969.408 с. § 21
Практична робота №5
Тема роботи – Розрахунок ентропії.
Мета роботи – навчитися розраховувати ентропію при переході системи із одного стану в інший.
Теоретичне обґрунтування
На основі другого закону термодинаміки внутрішню енергію системи можна представити, як суму
U = F + TS; F =U – TS,
де F – вільна енергія системи, тобто частина внутрішньої енергії,
яка може переходити в корисну роботу
TS – пов’язана енергія, не здатна переходити в роботу
S – міра “знеціненої” енергії – ентропія
Прийнято розраховувати зміну ентропії (S2 – S1) = Δ S
Для обчислення зміни ентропії при переході 1 моля ідеального газу з одного стану в інший користуються формулами:
S2 – S1 = R* ln *(V2/V1) + Cv* ln* (T2/T1)
S2 – S1 = R* ln *(P2/ P1) + Cp* ln* (T2/T1)
Для твердих та рідких речовин:
S2 – S1 = С * ln *(T2/T1),
де – С – питома теплоємкість
При переході речовини із одного агрегатного стану в інший:
S2 – S1 =L / T,
де –L – теплота фазового переходу (плавлення, випаровування, конденсації)
T – температура фазового переходу
Ентропія вимірюється в Дж/моль*град., кДж/Моль * град.)
Приклад № 1 Обчислити сумарну зміну ентропії Δ S при нагріванні 30г уксусної кислоти від температури (tпл = 16,6оС) до 60оС, теплота плавлення 194 Дж/г. Питома теплоємкість в інтервалі температур(0 – 80 оС) дорівнює 2,2 Дж/г * град.
Рішення Загальна зміна ентропії Δ S дорівнює суми змін ентропії плавленні Δ S1 та при нагріванні від температури плавлення
(16,6 оС) до (60 оС) Δ S2
Δ S = Δ S1 + Δ S2
Знаходимо зміну при плавленні Δ S = L / T; L = l * Mr:
l = 194 Дж / г; Mr(CH3COOH) = 60 г / моль
L = 194 Дж/г * 60 г/моль = 11640 Дж/моль
Тпл = 16,6 + 273 = 289,6 оК
Δ S1 = 11640/289,6 =40,2 Дж/град * моль
Для 30г кислоти число молей:
V =m / Mr = 30г / 60 г/ моль = 0,5 моль
Δ S1 = 40,2 Дж/град. * моль * 0,5моль = 20,1 Дж/ град
Знаходимо зміну ентропії для процесу нагрівання:
Δ S2 = C * ln * (T2/T1) = 30* 2,2 * ln * (273 + 60)/(273 + 16,6);
Δ S2 = 9,2 Дж/град.
Δ S = Δ S1 + Δ S2 = 20,1 Дж/град + 9,2 Дж/Град = 29,3 Дж/ град.
 2018-01-08
2018-01-08 762
762








