Гальванічний елемент, в якому джерелом енергії є не хімічна реакція, а робота вирівнювання іонів називається концентраційним. Він складається з двох однакових електродів, занурених в розчини з різною концентрацією іонів.
Наприклад:
Сu | CuSO4 ½½CuSO4 ½ Сu, або Ag | AgNO3 ½½ AgNO3 | Ag,
а1 а2 а1 а2
де, a1 < а2
Електрод, який знаходиться в більш розчиненому розчині, розчиняється та його іони переходять у розчин. Сам електрод при цьому заряджується негативно. На електроді, зануреному в більш концентрований розчин, осаджуються іони металу з розчину, та він заряджується позитивно. Таким чином, на обох електродах проходять процеси, які призводять до вирівнювання концентрації іонів у розчинах.
Потенціали електродів дорівнюють:
Е1 = Е1° + RT/nF ×ln a1
Е2 = Е2° + RT/nF ×In a2
Е2° = E1°
Віднімаючи перше рівняння з другого, отримаємо рівняння для електрорушійної сили концентраційного елементу:
Е = Е2 – Е1 = RT/nF × In a2/a1
Е = 0,059 / n × ln а2 /а1
Концентраційний елемент буде працювати до тих пір, поки активності іонів у розчинах не зрівняються; при а1 = а2 його ЕРС = 0. Різниця електричних потенціалів виникає при контакті двохрозчинів електролітів, якщо вони відрізняються концентрацією або природою розчиненої речовини. Внаслідок різності швидкості дифузії іонів у розчинах виникає дифузійна різність потенціалів чи дифузійний потенціал.
Окислювально–відновні гальванічні елементи складається з пластинок, які занурюють у розчини їх солей. Виникнення електричного струму в таких елементах є за рахунок окислювально-відновних реакцій. Платинові електроди (пластинки, занурені у розчини) служать тільки для передачі електронів, Е.Р.С. будь-якого гальванічного елемента знаходять за формулою:
Е = Е1 – Е2
де, Е - Е.Р.С. гальванічного елемента
Е1 і Е2 - потенціали, які виникають на електродах
Е1 - потенціал з більшою алгебраїчною величиною
Е2 - потенціал з меншою алгебраїчною величиною.
Потенціал Е знаходять за формулою Нернста:
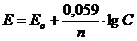
Де, Е0 - нормальний потенціал із таблиці
n - валентність металу в розчині солі
С - концентрація розчину, у який занурили електрод
Будь-який гальванічний елемент можливо виразити формулою, цю формулою називають схемою.
(-) Zn/ZnSO4//CuSO4/Cu (+)
(+)Ag/AgN03//AgN03/Ag(-)
C1 C2
де, С1 >С2
Електролізом називається електронний хімічний процес, який спостерігається при проходженні постійного електричного струму через електроліти. При електролізі на електроліті безперервно протікають окислювально-відновні процеси: на катоді – процес відновлення, на аноді – окислення. Продукти цих реакцій відкладаються на електроді, або вступають у повторні реакції (взаємодіють поміж собою з молекулами речовини електрода), або накопичуються в розчині електродів. Протікання первинних анодних і катодних процесів підпорядковуються законом, встановленим англійським вченим М.Фарадеєм (1834):
1. Маса речовини m, виділена на електроді електричним струмом, прямо пропорційна кількості електрики Q, яка пройшла через електроліт:
m = K × Q
Q = I × t
де: І – сила струму, А
t - час пропускання струму, сек
К – електрохімічний еквівалент, який дорівнює кількості речовини (кг), виділеного при проходженні 1 кулона (Кл), або 1 ампер × секунди (1 А × с) електрики.
m = K × І × t
2. Вага різних речовин, виділенні одною і тією ж кількістю електрики, прямо пропорційна їх хімічним еквівалентам (Е):

 2018-01-08
2018-01-08 721
721








