Усі розчини киплять при більш високій температурі, ніж чисті розчинники, а замерзають при більш низькій температурі. Це пов'язано з тиском пари над розчинам.
Закон Рауля: "Підвищення Dt кипіння розчину і зниження Dt замерзання пряме пропорційні молярній концентрації розчину":
Dtк = E ∙ C
Dt3 = К ∙ С
де, С - моляльна концентрація, яка виражається кількістю молів розчиненої речовини у 1000 г. розчинника.
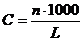
де, n - кількість молів розчиненої речовини
L - кількість розчинника

де, Е - ебуліоскопічна постійна величина, яка показує на скільки градусів підвищилась t кипіння розчинника, якщо в ньому присутній 1 моль речовини.

К - кріоскопічна постійна, яка показує на скільки градусів знизиться t замерзання розчинника, якщо у ньому розчинити 1 моль речовини, якщо: n = m / М, то отримаємо:


tk = 100 + Dtk
tз = 0 - Dtз
Визначення молекулярної ваги речовини методами кріоскопії і ебуліоскопії.
1) Якщо кріоскопічна константа К даного розчинника відома, то використовуючи формулу, можна знайти дослідним шляхом молекулярну масу розчинених речовин:

2) Пристрій для кріоскопічних вимірів.
У широкий товстостінний стакан з мішалкою, оточений зверху для термоізоляції ватою, кладуть охолоджену суміш з снігу або льоду і повареної солі. У цю суміш крізь кришку склянки опускають широку пробірку, в яку на пробці встановлюють більш вузьку пробірку, яка має боковий тубус, необхідний для введення наважки досліджуваної речовини. Пробірка закривається пробкою, крізь яку проходять термометр та мішалка.
3) Можна розрахувати молекулярну вагу, використовуючи ебуліоскопічну константу К:

Використовуючи цю формулу, визначають молекулярну вагу розчинених речовин по підвищенню точки кипіння розчину:
 ;
; 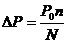 ;
;  ;
;  .
.
З цих формул видно, що всі фізичні властивості речовин неелектролітів залежать від кількості молів розчиненої речовини (n), а саме від часткової концентрації розчину, так як по кількості молів розчиненої речовини можливо знайти кількість молекул або часткову концентрацію розчину, яка виражається кількістю частин розчиненої речовини у визначеному об'ємі розчинника.
Запитання до семінару.
1. Чим відрізняється гомогенна система від гетерогенної?
2. Що називають фазою?
3. Що називають компонентом?
4. Що характеризує фазова діаграма?
5. Яка залежність між температурою плавлення і тиском найбільш типічна для більшості речовин?
6. Що називають розчином?
7. Як пояснити зниження розчинності газу з підвищенням температури?
8. На чому заснована екстракція речовини із розчину?
9. Який може бути тепловий ефект при розчинені рідини в рідині?
10. Від чого залежить осмотичний тиск розчину?
11. Як змінюється склад рідкої фази при замерзанні розчину?
12. Який вид прийме рівняння Гіббса, якщо на рівновагу подіє інший фактор?
13. Обчислити тиск пара 20 %-ного розчину глюкози при 25 0С. Тиск пара води при даній температурі дорівнює 3167,73 Н/м2.
14. Обчислити тиск пара розчину 6,4 г нафталіна в 90 г бензола при 20 0С. Тиск пара бензола при даній температурі дорівнює 9953,82 Н/м2.
15. В 200 г розчину нафталіна в бензолі містить 60 г нафталіна. Обчислити тиск пара розчину при 40 0С. Тиск пара бензола при 40 0С дорівнює 24144,6 Н/м2.
16. При розчинені 2,05 їдкого натрію в 100 г води температура кипіння підвищилась на 0,496 0С. Визначте ступінь дисоціації NaOH в розчині.
17. Знайти осмотичний тиск розчину сахарози при 0 0С, якщо відомо що при 20 0С осмотичний тиск цього розчину дорівнює 1,066 бар.
18. Знайти молекулярну вагу мочевини, якщо водний розчин містить 0,368 г мочевини в 200 см3 води при 20 0С,а осмотичний тиск дорівнює 74630 Н/м2.
19. Визначте температуру замерзання водного розчину СаСІ2, якщо ступінь дисоціації солі в розчині дорівнює одиниці. Концентрація розчину 0,5 % СаСІ2.
20. Температура замерзання чистого бензола 5,500 0С, а розчину, який містить 0,2242 г камфори в 30,55 г бензола, 5,25 0С. Визначте молекулярну вагу камфори в бензолі.
21. Обчислити тиск пара 1 % розчину хлористого натрія при 100 0С. Ступінь дисоціації солі в розчині дорівнює – 1 %. При 100 0С для води Ро= 101325 Н/м2.
Семінар № 4
Тема: Хімічна кінетика, хімічна рівновага, каталіз.
Мета: Вивчити основні поняття хімічної кінетики, навчитися визначати швидкість прямої та зворотної реакції, хімічну рівновагу, користуватися принципом Ле-Шательє, визначати умови перебігу прямої та зворотної реакції. Вивчити класифікацію хімічних реакцій: молекулярні реакції, сполучені, ланцюгові та каталітичні. Навчитися відрізняти гомогенні та гетерогенні каталітичні реакції, вплив ферментів на проходження каталітичних реакцій.
Методичні вказівки.
Сутність хімічної реакції зводиться до розриву зв'язків у вихідних речовинах та виникнення нових зв'язків в продовженні реакції. Утворення зв’язків проходить з виділенням теплоти, розрив з поглинанням теплоти. З швидкістю хімічної реакції пов'язані уявлення про перетворення речовин. Вчення про швидкість хімічної реакції називається хімічною кінетикою.
Під швидкістю хімічної реакції розуміють зміну концентрації одної з реагуючих речовин за одиницю часу при незмінному об'ємі системи.
Практика показує, що при збільшенні концентрації реагуючих речовин швидкістьреакції збільшується. К. Гульдберг та П.Bare (І867p.) відкрили основний закон хімічної кінетики - закон діючих мас: при постійній температурі швидкість хімічної реакції прямо пропорційна добутку концентрації реагуючих речовин.
Н2 + І2 Û 2НІ, V = k[H2]×[I2],
2NO + О2 Û 2NO2, V = k[NO]2×[О2]
V = k[A]m × [B]n
для реакції типу mA + nB ® С - це гомогенні реакції
k - коефіцієнт пропорційності чи const швидкості реакції
[ А ] [ В ] - молярні концентрації речовин А та В
m та n - стехіометричні коефіцієнти.
V = kCam ∙ Свn
Фізична суть k: якщо концентрація кожної з реагуючих речовин дорівнює
1 моль/л, тоді V = k, кінетичне рівняння реакції.
В кінетичне рівняння не включають речовини, які знаходяться в твердому стані, оскільки вони реагують поверхнево, а не всім об'ємом.
С + О2 = СО2 V = k [О2]
Реакція протікає тим швидше, чим більше концентрація О2. Це гетерогенні реакції. Для них треба враховувати 3 стадії:
1) вступ реагуючих речовин до поверхні;
2) хімічна взаємодія на поверхні;
3) звільнення поверхні від продукту реакції.
 2018-01-08
2018-01-08 1768
1768








