Изобарный процесс (p=const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, которая параллельна оси V. При изобарном процессе работа газа при увеличения объема от V1 до V2 равна
 (2)
(2)
и равна площади заштрихованного прямоугольника (рис. 2). Если использовать уравнение Менделеева-Клапейрона для выбранных нами двух состояний, то
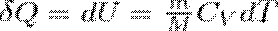 и
и 
 откуда
откуда

Тогда выражение (2) для работы изобарного расширения примет вид
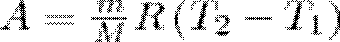 (3)
(3)
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2 —T1 = 1К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
Рис.1
В изобарном процессе при сообщении газу массой m количества теплоты

ее внутренняя энергия возрастает на величину (т.к. CV=dUm/dt)

При этом газ совершит работу, определяемую выражением (3).
Изотермический процесс (T=const). Изотермический процесс описывается законом Бойля—Мариотта:
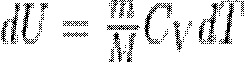
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу, которая расположена на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Исходя из формул для работы газа и уравнения Менделеева-Клайперона найдем работу изотермического расширения газа:

Так как при Т=const внутренняя энергия идеального газа не изменяется:

то из первого начала термодинамики (δQ=dU+δA) следует, что для изотермического процесса

т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
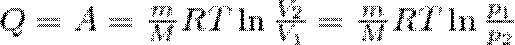 (4)
(4)
Значит, для того чтобы при расширении газа температура не становилась меньше, к газу в течение изотермического процесса необходимо подводить количество теплоты, равное внешней работе расширения.
41. Применение первого закона термодинамики к изохорическому и адиабатическому процессам.
Изохорный процесс (V=const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат. При изохорном процессе газ не совершает работы над внешними телами, т. е.

Из первого начала термодинамики (δQ=dU+δA) для изохорного процесса следует, что вся теплота, которая сообщается газу, идет на увеличение его внутренней энергии:

т.к. CV=dUm/dt,

Тогда для произвольной массы газа получим
 (1)
(1)
Процесс, протекающий в системе, которая не обменивается теплом с окружающими телами. Процесс в теплоизолированной системе называют адиабатным.
При адиабатном процессе Q =0 и согласно уравнению (13.10) изменение внутренней энергии происходит только за счет совершения работы:

Конечно, нельзя окружить систему оболочкой, абсолютно не допускающей теплопередачу. Но в ряде случаев можно считать реальные процессы очень близкими к адиабатным. Для этого они должны протекать достаточно быстро, так, чтобы за время процесса не произошло заметного теплообмена между системой и окружающими телами.
Согласно уравнению (13.14) при совершении над системой положительной работы, например при сжатии газа, его внутренняя энергия увеличивается, что означает повышение температуры газа. И наоборот, при расширении газа сам газ совершает положительную работу  и его внутренняя энергия уменьшается - газ охлаждается.
и его внутренняя энергия уменьшается - газ охлаждается.
 2018-01-08
2018-01-08 1434
1434








