1)Сте́пени свобо́ды — характеристики движения механической системы. Число степеней свободы определяет минимальное количество независимых переменных (обобщённых координат), необходимых для полного описания движения механической системы. Также число степеней свободы равно полному числу независимых уравнений, полностью описывающих динамику системы.
Подавляющее большинство физических систем может находиться не в одном, а во многих состояниях, описываемых как непрерывными (например, координаты тела), так и дискретными (например, квантовые числа электрона в атоме) переменными. Независимые «направления», переменные, характеризующие состояния системы, называются степенями свободы.
2) Число степеней свободы - наименьшее количество параметров которые необходимо задать чтобы обнозначно определить положение тела в пространстве. обозначаеться i.
минимальное значение которое может принять i это 3.
т.к. три координаты х,y,z. Это значит что Материальная точка движеться только поступательно.
Но если тело, или молекула врашаеться то каждому врашательному движению приписываеться ещё одна степень свободы.
В случае двухатомного газа i=5.
т.к. его молекула может врашаться в двух перпендикулярных плоскостях.
В случае трёхатомного газа i=6.
т.к. его молекула способна врашаться в трёх взаимно-перпендикулярных плоскостях.
При увеличении температуры, атомы в молекулах начинают колеваться. Каждому колебательнгому движению приписывают две степени свободы. Одна соответствует кинетической энергие, другая потенциальной энергие взаимодействия. По этому с увеличением температуры увеличиваеться число степеней свободы для 2-х и более -атомных молекул.
M - произволиная масса газа.
N - про-ное кол-во чатиц.
Внутреняя энергия одной молекулы

Умножив на кол-во молекул получи энергию всего газа
U - внутреняя энергия
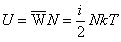
если газа 1 моль
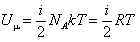
Если газа (ню) молей

или
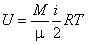
Эта энергия называется внутренней энергией идеального газа.
Вообще же внутренней энергией тела называется полная энергия, относящаяся к самим молекулам, т. е. их «невидимая» энергия. Сюда входит кинетическая энергия движения самих молекул, кинетическая энергия движения атомов внутри молекулы (если молекула не одноатомная), потенциальная энергия взаимодействия между атомами внутри молекулы и даже кинетическая энергия частиц, входящих в состав атомов (ядер и электронов). Она, однако, не включает ту кинетическую энергию, которой газ может обладать, если он, как целое, движется, и ту потенциальную энергию, которой он может обладать, если находится в поле каких-нибудь сил. Внутренняя энергия данной массы идеального газа зависит, как это видно из формул, только от температуры и не зависит ни от давления, ни от объема газа. (Для неидеальных газов это неверно.)
Из приведенных формул видно, что для изменения температуры газа нужно изменить его внутреннюю энергию. Изменение же энергии, как это известно из механики, связано с работой: энергия тела изменяется, если тело совершает работу или над телом совершается работа, и это изменение как раз равно совершенной работе.
Отсюда как будто бы следует, что изменение температуры газа или вообще какого-либо тела может быть достигнуто только за счет механической работы.: для нагревания тела над ним надо совершить работу, а для охлаждения нужно создать такие условия, при которых оно само могло бы совершить работу. Опыт показывает, что температуру тела в самом деле можно изменить путем затраты соответствующей механической работы. Так, например, при трении тел друг о друга они нагреваются (на этом основан древнейший способ добывания огня). Как будет показано ниже, газ тоже может быть нагрет за счет совершения работы.
 2018-01-08
2018-01-08 3323
3323
