Из молекулярно-кинетического определения идеального газа как совокупности большого числа хаотически движущихся невзаимодействующих материальных точек следует, что единственной формой энергии частиц идеального газа может быть только их кинетическая энергия поступательного движения, вычисленная по отношению к скорости центра масс газа. Тогда под внутренней энергией идеального газа следует понимать суммарную кинетическую энергию поступательного движения частиц, т.е.
 , (2.24)
, (2.24)
где 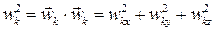 ; N - число частиц; m - масса одной частицы (все частицы предполагаются одинаковыми). Дальнейшее развитие теории и сравнение с экспериментальными данными показало, что точечным частицам истинного идеального газа следует тем не менее приписать наличие внутренней структуры. "Точки" в идеальном газе идентифицируются с атомами; если же газ состоит из многоатомных молекул, т.е. из пространственных структур, то при вычислении внутренней энергии такого газа следует учитывать также энергию вращательного движения молекул и энергию колебаний атомов в молекулах. С учётом этого вместо (2.24) следует записать
; N - число частиц; m - масса одной частицы (все частицы предполагаются одинаковыми). Дальнейшее развитие теории и сравнение с экспериментальными данными показало, что точечным частицам истинного идеального газа следует тем не менее приписать наличие внутренней структуры. "Точки" в идеальном газе идентифицируются с атомами; если же газ состоит из многоатомных молекул, т.е. из пространственных структур, то при вычислении внутренней энергии такого газа следует учитывать также энергию вращательного движения молекул и энергию колебаний атомов в молекулах. С учётом этого вместо (2.24) следует записать
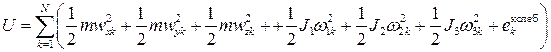 .(2.25)
.(2.25)
Здесь  - моменты инерции молекулы относительно её главных осей;
- моменты инерции молекулы относительно её главных осей;  - проекции вектора угловой скорости вращения молекулы на её главные оси. Энергией колебаний атомов в молекулах
- проекции вектора угловой скорости вращения молекулы на её главные оси. Энергией колебаний атомов в молекулах  при не очень больших температурах можно пренебречь. Моменты инерции молекулы
при не очень больших температурах можно пренебречь. Моменты инерции молекулы  зависят от её конфигурации, т.е. от положения атомов в молекуле, а также от количества атомов в молекулах. Если молекула одноатомная, то все три её момента инерции равны нулю, если молекула двухатомная (или многоатомная с линейным расположением атомов), то один из её моментов инерции (а именно относительно главной оси, проходящей через атомы) равен нулю, а остальные два отличны от нуля и одинаковы. В общем случае трёх- и более атомной молекулы все три момента инерции отличны от нуля и различны. Таким образом, если пренебречь колебаниями атомов в молекулах, каждая из молекул газа может совершать три движения поступательного характера (движение центра инерции молекулы вдоль трёх осей координат x, y, z) и ноль, два или три вращательных движений (соответственно для одно-, двух- или трёх- и более атомных молекул). Как известно из механики, каждое из возможных движений тела носит название степени свободы. Обозначим число степеней свободы молекулы f. Можно сказать, что каждая из степеней свободы молекулы № k обладает энергией
зависят от её конфигурации, т.е. от положения атомов в молекуле, а также от количества атомов в молекулах. Если молекула одноатомная, то все три её момента инерции равны нулю, если молекула двухатомная (или многоатомная с линейным расположением атомов), то один из её моментов инерции (а именно относительно главной оси, проходящей через атомы) равен нулю, а остальные два отличны от нуля и одинаковы. В общем случае трёх- и более атомной молекулы все три момента инерции отличны от нуля и различны. Таким образом, если пренебречь колебаниями атомов в молекулах, каждая из молекул газа может совершать три движения поступательного характера (движение центра инерции молекулы вдоль трёх осей координат x, y, z) и ноль, два или три вращательных движений (соответственно для одно-, двух- или трёх- и более атомных молекул). Как известно из механики, каждое из возможных движений тела носит название степени свободы. Обозначим число степеней свободы молекулы f. Можно сказать, что каждая из степеней свободы молекулы № k обладает энергией 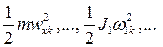 соответственно, причём эта энергия хаотическим образом меняется с течением времени вследствие столкновений молекул. Австрийский физик Людвиг Больцман в конце XIX века методами статистической физики доказал теорему о равнораспределении энергии по степеням свободы, согласно которой в среднем в равновесии на каждую степень свободы молекулы приходится одинаковая энергия, равная
соответственно, причём эта энергия хаотическим образом меняется с течением времени вследствие столкновений молекул. Австрийский физик Людвиг Больцман в конце XIX века методами статистической физики доказал теорему о равнораспределении энергии по степеням свободы, согласно которой в среднем в равновесии на каждую степень свободы молекулы приходится одинаковая энергия, равная 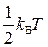 , где
, где  постоянная Больцмана. На основании теоремы о равнораспределении выражение для внутренней энергии идеального газа (2.25) можно записать в более простой форме:
постоянная Больцмана. На основании теоремы о равнораспределении выражение для внутренней энергии идеального газа (2.25) можно записать в более простой форме:
 . (2.26)
. (2.26)
Количество молекул N можно вычислить как произведение числа киломолей ν газа и числа Авогадро N A, в свою очередь число киломолей может быть подсчитано делением массы газа M на молекулярную массу газа μ, определяемую его химической формулой. Таким образом, (2.26) принимает вид
 . (2.27)
. (2.27)
Используя численные значения числа Авогадро и постоянной Больцмана, находим  , т.е. это произведение в точности равно универсальной газовой постоянной. Окончательное выражение для внутренней энергии идеального газа имеет, следовательно, вид
, т.е. это произведение в точности равно универсальной газовой постоянной. Окончательное выражение для внутренней энергии идеального газа имеет, следовательно, вид
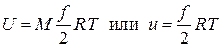 . (2.28)
. (2.28)
Энтальпия идеального газа легко находится из определения (2.11) и термического уравнения состояния (1.46):
 . (2.29)
. (2.29)
Как и следовало ожидать, внутренняя энергия и энтальпия для идеального газа зависят только от температуры и не зависят ни от объёма, ни от давления, т.е. для идеального газа имеем:
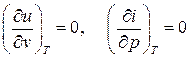 . (2.30)
. (2.30)
Это объясняется отсутствием взаимодействия между молекулами идеального газа.
 2017-10-25
2017-10-25 621
621








