Q - энергия, которую тело теряет или приобретает при передаче тепла.
Формула количества теплоты зависит от протекающего процесса.
Формулы количества теплоты при некоторых процессах:
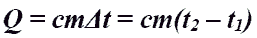 Количество теплоты при нагревании и охлаждении.
Количество теплоты при нагревании и охлаждении.
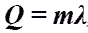 Количество теплоты при плавлении или кристаллизации.
Количество теплоты при плавлении или кристаллизации.
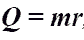 Количество теплоты при кипении, испарении жидкости и конденсации пара.
Количество теплоты при кипении, испарении жидкости и конденсации пара.
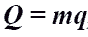 Количество теплоты при сгорании топлива.
Количество теплоты при сгорании топлива.
Количество теплоты всегда передается о т более горячих тел к более холодным до достижения ими одинаковой температуры (теплового равновесия), если нет иных процессов, кроме теплопередачи.
В замкнутой системе тел выполняется уравнение теплового балланса: Q1 + Q2 +... = 0 - количество теплоты, которое теряют горячие тела, равно количеству тепла, получаемому холодными.
Полезные формулы:
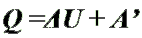 Количество теплоты, переданное телу,
Количество теплоты, переданное телу,
идет на изменение его внутренней энергии
и на совершение им работы (Первый закон термодинамики).
Закон Джоуля-Ленца: в неподвижном металлическом проводнике вся энергия электрического тока превращается в тепло:
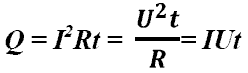 - закон Джоуля - Ленца.
- закон Джоуля - Ленца.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца[1]. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
 2018-01-08
2018-01-08 2122
2122