Первый закон термодинамики не накладывает никаких ограничений на направление превращений энергии из одной формы в другую и на направление перехода теплоты между телами. Второе начало указывает направление движения энергии: от каких тел, в каком соотношении, через какие формы. Работа любой тепловой машины представляет собой круговой процесс или цикл, после совершения которого система возвращается в исходное состояние. При этом рабочее вещество (пар, газ) получив тепло Q1 от тел более высокой температуры (нагревателей), чтобы вернуться к исходному состоянию, должно отдать часть тепла Q2 телам более низкой температуры (холодильникам). В противном случае работа по возвращению к исходному состоянию сведет к нулю всю полезную работу. Следовательно полезная работа каждого цикла А = Q1 – Q2, а КПД машины равен
С целью увеличения К.П.Д. тепловых машин были предприняты теоретические исследования работоспособности идеальных закрытых тепловых систем, т.е мысленных систем, полностью изолированных от возможности обмена энергией с внешней средой, общее количество внутренней энергии которых не может измениться.
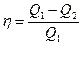 |
Французский физик Карно провел мысленный эксперимент с идеальной тепловой машиной совершающей полностью обратимый цикл, в которой энергия Q2, отдаваемая холодильнику, используется в работе по возвращению системы в исходное состояние, без теплового обмена со средой. Такая машина является идеальной обратимой замкнутой тепловой системой, в которой КПД можно рассчитать по формуле
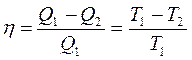
Где Q1 - количество тепла, отданного нагревателем в систему
Q2 - кол–во тепла, отданного холодильнику системы.
Т1 – температура нагревателя
Т2 – температура холодильника
Данное равенство справедливо только для идеальной системы, в которой не происходит потерь энергии. В реальной тепловой машине:
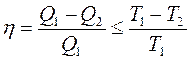
Это выражение получило название основного неравенства 2-го начала термодинамики. Преобразуя его, получается:
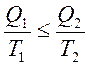 или
или 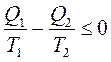
Однако по условиям мысленного эксперимента Q2 отдается обратно в систему и, следовательно, должно быть взято с противоположным знаком:
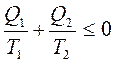

Выражение Q / T называется приведенным теплом, т.е. в этом выражении сумма приведенного в замкнутую обратимую систему тепла в идеальном случае = 0, а в реальных условиях - величина отрицательная, т.е. отдача тепла холодным телом более теплому невозможна. Другими словами: тепловая энергия передается только в одном направлении – от теплого к холодному.
В результате этих мысленных экспериментов были сделаны следующие выводы, ставшие основными положениями второго начала термодинамики:
1. Тепловая энергия передается только в одном направлении – от теплого к менее теплому.
2. Превращаться в работу может только часть тепловой энергии, передаваемой от теплого к холодному. То есть главным условием работы тепловой энергии является не источник тепла («нагреватель»), а «холодильник».
Следствиями этих положений являются:
а. Полное преобразование любой формы энергии в работу или другую форму энергии, за исключением тепловой, невозможно; часть энергии обязательно теряется в форме тепла.
б. Совершение работы за счет внутренней энергии замкнутой системы возможно только при неравномерном распределении этой энергии внутри системы.
То есть в круговом процессе полезная работа может осуществиться только при условии передачи части тепла от нагревателя к холодильнику. Осуществить периодический процесс, полностью переводящий в механическую работу тепло только одного резервуара (нагревателя без холодильника), то есть получить КПД равный 100% невозможно
Машину, которая обладала бы КПД в 100%, называют вечным двигателем второго рода. Существование такой машины не противоречило бы закону сохранения энергии (первому началу термодинамики), однако она была бы выгодна не меньше вечного двигателя первого рода: запасы тепловой энергии на Земле громадны. Если бы удалось превратить в работу тепло, заключенное в океане, то это было бы также выгодно, как получение работы без всяких затрат энергии. Поэтому второе начало термодинамики можно формулировать так:
· Невозможно использовать для работы внутреннюю энергию вещества путем его охлаждения, так как даже если энергия, потраченная на работу по охлаждению (работу «холодильника»), будет равна отдаваемому веществом теплу (идеальный случай), в полезную работу может быть преобразована только часть этого, отданного веществом тепла. Следовательно, реализация проектов, предлагающих использовать внутреннюю тепловую энергию природных объектов (например, водоемов) путем их охлаждения – проекты вечного двигателя второго рода – невозможна.
Дальнейшая работа с исследованием основного неравенства второго начала термодинамики привела к возникновению нового физического понятия: если в замкнутом обратимом процессе происходит бесконечно малое увеличение суммы приведенного тепла так, что температура системы при этом остается постоянной, то такое выражение является простым дифференциалом некой функции S: 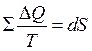 .
.
Если величину S подставить в основное неравенство, то получится, что в идеальном случае она остается постоянной, а в реальных условиях будет возрастать.
Прямые наблюдения за тепловым процессом не давали оснований предположить существование величины S. Была выдвинута идея, что эта величина отражает какое-то внутреннее состояние системы и изменение этого состояния. Данная величина получила название энтропия. В любой замкнутой системе в идеальных (полностью обратимых) условиях энтропия постоянна, а в реальных условиях идет постоянное увеличение энтропии.
Отсюда вытекает еще одно положение второго начала термодинамики:
· Работоспособность замкнутой закрытой системе, не смотря на сохранения исходного количества внутренней энергии, неизбежно снижается до нуля. Другими словами, внутренняя энергия системы необратимо «обесценивается», хотя никуда и не исчезает. Для определения меры этого необратимого «обесценивания» энергии было введено новое физическое понятие – энтропия.
При этом, хотя количество энергии в замкнутых системах сохраняется, распределение энергии в системе меняется необратимым способом. Представьте себе, замкнутую изолированную тепловую систему в виде химически однородного предмета, одна часть которого значительно теплее другой его части (допустим: +900 – одна часть, и +450 – другая часть), полностью изолированного от какого бы то ни было теплового обмена с окружающей средой. Данное неравномерное распределение тепловой энергии внутри системы (предмета) на молекулярном уровне можно себе представить как упорядоченное распределение молекул вещества в зависимости от скорости их беспорядочного движения. Молекулы с высокой скоростью движения и соответственно более высокой кинетической энергии сосредоточены в одной части системы (предмета), а молекулы с низкой скоростью и энергией – в другой. В силу беспорядочного движения и неизбежных столкновений и тех и других молекул друг с другом между ними идет постоянный обмен частью кинетической энергии, в результате которого скорость движения и кинетическая энергия одних молекул повышается, а других понижается, то есть идет передача энергии от теплой части предмета к холодной. Часть этого тепла в соответствие со вторым началом термодинамики может быть использована в работе. Но, по мере того, как разница температур между частями предмета уменьшается, распределение тепла внутри системы становится все более равномерным, и количество тепловой энергии, передаваемое в единицу времени от теплой части предмета к холодной, становится все меньше, способность внутренней энергии системы совершать работу снижается. Когда разница в тепловой энергии между частями системы полностью нивелируется, продолжение работы станет невозможно, так как, хотя общее количество энергии в системе не изменилось, переход энергии от теплого к холодному прекратился. В условиях тепловой однородности системы (предмета) скорость движения молекул не может быть одинаковой в силу передачи части энергии одних молекул другим при неизбежных столкновениях. В то же время в силу беспорядочного, случайного непредсказуемого характера движения молекул наиболее вероятным является статистически равномерное распределение внутри системы (предмета) молекул с разной скоростью движения и кинетической энергией.
Таким образом, наиболее вероятным, а значит и устойчивым состоянием изолированной (закрытой) замкнутой тепловой системы является максимально беспорядочное движение молекул, что приводит к равномерному распределению внутри системы тепловой энергии и невозможности использования этой энергии в работе.
В качестве другого примера представим себе, что в сосуде, заполненном газом, все молекулы соберутся только в одной части этого сосуда. Такое состояние является наименее вероятным и потому неустойчивым, но зато высокоупорядоченным. Более вероятным и устойчивым будет равномерное распределение молекул по всему сосуду, поэтому система будет стремиться перейти из первого состояния во второе - более беспорядочное, хаотичное, т.е. в первом случае энтропия будет минимальной, а во втором - максимальной для данной системы. При этом суммарная кинетическая энергия молекул газа (тепловая энергия системы) останется той же самой. А вот распределение ее внутри системы в силу низкой вероятности первого состояния изменится необратимо. Представьте себе, что в сосуде, заполненном газом, все молекулы соберутся только в одной части этого сосуда. Такое состояние является наименее вероятным и потому неустойчивым, но зато высокоупорядоченным. Более вероятным и устойчивым будет равномерное распределение молекул по всему сосуду, поэтому система будет стремиться перейти из первого состояния во второе - более беспорядочное, хаотичное, т.е. в первом случае энтропия будет минимальной, а во втором - максимальной для данной системы. При этом суммарная кинетическая энергия молекул газа (тепловая энергия системы) останется той же самой. А вот распределение ее внутри системы в силу низкой вероятности первого состояния изменится необратимо.
Упорядоченное, в зависимости от скорости и кинетической энергии, распределение молекул, выливающееся в неравномерное распределение тепла внутри системы, в силу того же постоянного хаотического движения является мало вероятным, а потому неустойчивым временным состоянием. Процесс перехода тепла от одной части системы к другой является результатом неизбежности перехода системы из неустойчивого упорядоченного состояния к устойчивому максимально беспорядочному состоянию.
Таким образом, понятие энтропии, отражавшее абстрактный умозрительный процесс «деградации и обесценивания» энергии становится отражением реального процесса перехода систем от неустойчивого упорядоченного состояния с неравномерным распределением энергии к устойчивому беспорядочному состоянию с равномерным распределением энергии. С учетом всеобщности и фундаментальности закона сохранения и превращения энергии, энтропии можно дать определение как меры перехода системы от упорядоченного состояния к хаосу, или меры беспорядка в системе.
Следовательно, третьим основным положением второго начала термодинамики будет:
3. В замкнутых закрытых системах энтропия неизбежно возрастает или остается на максимальном уровне. Другими словами, любая закрытая упорядоченная система неизбежно стремится к беспорядку.
Итак, введение во второе начало термодинамики понятия энтропии показало, что превращение энергии из одной формы в другую возможно только, если оно приводит к увеличению энтропии. Поэтому все формы энергии удобно классифицировать в порядке возрастания их «ценности». «Высший класс» получают те из них, которые способны превращаться в большее число форм энергии. При этом переход части энергии в работу возможен только в процессе ее превращения из одной формы в другую. Низший класс достается тепловой энергии, превращения которой ограничены принципом Карно, то есть передачей тепла от более теплого менее теплому.
Законы термодинамики носят статистический вероятностный характер и не отрицают возможности случайного формирования более упорядоченного состояния системы. Используем тот же пример с сосудом, заполненным газом. В силу абсолютно непредсказуемого хаотичного движения молекул всегда есть очень малая вероятность, что на какой то момент в одной части сосуда соберется большее количество молекул, то есть появится кратковременная зона упорядоченности. Так как это состояние маловероятно, а значит неустойчиво, молекулы быстро распространятся опять по всему объему сосуда и система вернется к равновесию и максимальной энтропии. Такие случайно возникающие временные зоны упорядоченности в равновесных системах называют флуктуации. В замкнутых закрытых системах флуктуации всегда носят временный характер, так как в соответствие с законом возрастания энтропии случайно образовавшаяся зона упорядоченности и неравномерного распределения энергии неизбежно переходит к равномерному распределению энергии и максимальному беспорядку
Достоинство законов термодинамики в том, что они позволяют рассматривать общие свойства систем независимо от внутренней природы конкретной системы. То есть общие закономерности установления равновесия применимы к любому веществу, к любым системам, поэтому они вошли не только во все разделы физики, но и в химию, в биологию, инженерию, кибернетику.
 2015-01-21
2015-01-21 1707
1707
