Индикаторы обычно используют, добавляя несколько капель водного или спиртового раствора, либо немного порошка (например, смесь мурексида с хлоридом натрия) к пробе исследуемого раствора. Так, при титровании, в аликвоту исследуемого раствора добавляют индикатор, и наблюдают за изменениями цвета в точке эквивалентности.
Другой способ применения - использование полосок бумаги, пропитанных раствором индикатора или смеси индикаторов и высушенных (например, "Универсальный индикатор"). Такие полоски выпускают в самых разнообразных вариантах - с нанесенной на них цветной шкалой - эталоном цвета (в том числе для окрашенных или мутных сред), или с напечатанными числовыми значениями рН; для точного измерения в узких диапазонах рН, и для ориентировочного исследования растворов; в рулончиках, коробках и пеналах, или в виде отрывных книжечек.
Современные индикаторные полоски могут быть изготовлены с красителем - индикатором, привитым к целлюлозе или иному полимеру. Это делает их устойчивыми к вымыванию, вплоть до многократного использования.
[править]Кислотно-основные индикаторы (водные растворы)
[править]Интервалы перехода цвета индикаторов
На рисунке приведены ориентировочные данные о существовании разных цветных форм индикаторов в водных растворах.
Более точные сведения (несколько переходов, численное значение рН) см. в следующем разделе.

25 вопрос
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
3H2 + N2 ⇌ 2NH3.
Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция
N2O4 ⇌ 2NO2
складывается из элементарных реакций
N2O4 ⇌ 2NO2 и 2NO2 ⇌ N2O4.
Для обратимости сложной (многостадийной) реакции, например уже упоминавшейся реакции синтеза аммиака, необходимо, чтобы были обратимы все составляющие её стадии.
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.
Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции.
Вопрос
Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли(напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях.
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферныйраствор, боратный буферный раствор, формиатный буферный раствор и др.).
Значение pH буферного раствора можно рассчитать по формуле: 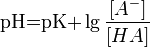 , где pK это отрицательный десятичный логарифм от константы диссоциации кислоты
, где pK это отрицательный десятичный логарифм от константы диссоциации кислоты
27 вопрос
СТАНДАРТНОЕ СОСТОЯНИЕ в химической термодинамике, состояние системы, выбираемое как состояние отсчета при оценке термодинамич. величин. Необходимость выбора стандартного состояния обусловлена тем, что в рамках хим. термодинамики не м.б. рассчитаны абс. значения энергий Гиббса, хим. потенциалов, энтальпий и др. термодинамич. величин для данного в-ва; возможен расчет лишь относит. значений этих величин в данном состоянии в сравнении с их значением в стандартном состоянии.
Стандартное состояние выбирают из соображений удобства расчетов; оно может меняться при переходе от одной задачи к другой. Значения термодинамич. величин в стандартном состоянии называют стандартными и обозначают обычно нулем в верх. индексе, напр. G0, H0, 0-соотв. стандартные энергия Гиббса, энтальпия, хим. потенциал в-ва. Для хим. р-ции G0, H0, S0 равны изменениям соотв. G0, H0 и S0 реагирующей системы в процессе перехода от исходных в-в в стандартном состоянии к продуктам р-ции в стандартном состоянии.
Стандартное состояние характеризуется стандартными условиями: давлением p0, т-рой Т0, составом (молярная доля x0). КомиссияИЮПАК по термодинамике определила (1975) в качестве основного стандартного состояния для всех газообразных в-в чистое в-во (х0 = 1) в состоянии идеального газа с давлением р0 = 1 атм (1,01 · 105 Па) при любой фиксир. т-ре. Для твердых и жидких в-в основное стандартное состояние-это состояние чистого (х0 = 1) в-ва, находящегося под внеш. давлением р0 = 1 атм. В определение стандартного состояния ИЮПАК Т0 не входит, хотя часто говорят о стандартной т-ре, равной 298,15 К.
Мн. газы при давлении 1 атм не могут рассматриваться как идеальный газ. Стандартное состояние в этих случаях не реальное, а некое гипотетич. состояние. Подобный искусств. выбор стандартного состояния объясняется простотой расчетов термодинамич. ф-ций дляидеального газа.
Для процесса образования хим. соединения из простых в-в в термодинамич. справочниках приводятся стандартные энергии Гиббса 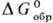 , энтальпии
, энтальпии 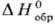 , энтропии
, энтропии 
Для определения этих величин выбирают нек-рые простые в-ва, для к-рых, по определению, выполняются условия:  = 0,
= 0, 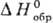 =0,
=0,  = 0. В качестве стандартного состояния для простых в-в принимают устойчивое фазовое и хим. состояние элемента при данной т-ре. Это состояние не всегда совпадает с естественным; так, стандартное состояние простого в-ва фтора при всех т-рах-чистый идеальный газ при 1 атм, состоящий из молекул F2; при этом не учитывается диссоциация F2 на атомы. Стандартное состояние может быть разным в разл. температурных интервалах. Для Na, напр., в интервале от 0 до Тпл (370,86 К) стандартное состояние простого в-ва-чистый металлич. Na при 1 атм; в интервале от Тпл до Tкип (1156,15 К)-чистый жидкий Na при 1 атм; выше 1156,15 К-идеальный газ при 1 атм, состоящий исключительно из атомов Na. Т. обр., стандартная энтальпия образования твердого NaF ниже 370,86 К соответствует изменению энтальпии в р-ции Na (тв) + 1/2F2 = = NaF (тв), а в интервале 370,86-1156,15 К соответствует изменению энтальпии в р-ции Na (жидк) + 1/2 F2 = NaF(TB).
= 0. В качестве стандартного состояния для простых в-в принимают устойчивое фазовое и хим. состояние элемента при данной т-ре. Это состояние не всегда совпадает с естественным; так, стандартное состояние простого в-ва фтора при всех т-рах-чистый идеальный газ при 1 атм, состоящий из молекул F2; при этом не учитывается диссоциация F2 на атомы. Стандартное состояние может быть разным в разл. температурных интервалах. Для Na, напр., в интервале от 0 до Тпл (370,86 К) стандартное состояние простого в-ва-чистый металлич. Na при 1 атм; в интервале от Тпл до Tкип (1156,15 К)-чистый жидкий Na при 1 атм; выше 1156,15 К-идеальный газ при 1 атм, состоящий исключительно из атомов Na. Т. обр., стандартная энтальпия образования твердого NaF ниже 370,86 К соответствует изменению энтальпии в р-ции Na (тв) + 1/2F2 = = NaF (тв), а в интервале 370,86-1156,15 К соответствует изменению энтальпии в р-ции Na (жидк) + 1/2 F2 = NaF(TB).
Стандартное состояние иона в водном р-ре вводится для возможности пересчета экспериментально определяемых энтальпийрастворения aqН0 (Н2О) в энтальпии образования хим. соединения. Так, если известна стандартная энтальпия растворения в водеКСl, а Н0обр [К+, р-р] и  [Сl-, р-р]-соотв. энтальпии образования ионов К+ и Сl в стандартном состоянии в водном р-ре, то стандартная энтальпия образования КСl м. б. рассчитана по ур-нию:
[Сl-, р-р]-соотв. энтальпии образования ионов К+ и Сl в стандартном состоянии в водном р-ре, то стандартная энтальпия образования КСl м. б. рассчитана по ур-нию:  [КСl, тв] = = - aqH0(Н20) +
[КСl, тв] = = - aqH0(Н20) +  [К+, р-р] +
[К+, р-р] +  [Сl-, р-р].
[Сl-, р-р].
В качестве стандартного состояния иона в водном р-ре, согласно рекомендациям ИЮПАК, принимают состояние данного иона в гипотетич. одномоляльном водном р-ре, в к-ром для рассматриваемого иона энтальпия равна его энтальпии в бесконечно разб. р-ре. Кроме того, принимают, что энтальпия образования иона Н+ в стандартном состоянии, т.е.  [Н+, р-р, Н2О] равна нулю. В результате появляется возможность получения относительных стандартных энтальпий образования др. ионов в р-ре на основе наиб. надежных (ключевых) значений энтальпий образования хим. соединений. В свою очередь, полученные значения энтальпий образованияионов в р-ре служат для определения неизвестных энтальпий образования хим. соед. в тех случаях, когда стандартные энтальпиирастворения измерены.
[Н+, р-р, Н2О] равна нулю. В результате появляется возможность получения относительных стандартных энтальпий образования др. ионов в р-ре на основе наиб. надежных (ключевых) значений энтальпий образования хим. соединений. В свою очередь, полученные значения энтальпий образованияионов в р-ре служат для определения неизвестных энтальпий образования хим. соед. в тех случаях, когда стандартные энтальпиирастворения измерены.
Стандартное состояние компонентов двух- и многокомпонентных систем вводится как состояние отсчета при расчетах термодинамич.активностей, энергий Гиббса, энтальпий, энтропии смешения (последние три величины в стандартном состоянии равны нулю). Возможен т. наз. симметричный выбор стандартного состояния, при к-ром в качестве стандартного состояния компонента используется его основное стандартное состояние, определенное согласно ИЮПАК. Если многокомпонентная система является жидкой, то и в качестве стандартного состояния компонентов берется их жидкое состояние. Альтернативой служит антисимметричный выбор стандартного состояния, когда для р-рителя сохраняется стандартное состояние, выбранное согласно рекомендациям ИЮПАК, а для растворенного в-ва А в качестве стандартного состояния выбирается его состояние в р-ре единичной концентрации, обладающим св-вами бесконечно разб. р-ра. Выбор стандартного состояния в этом случае связан с определенной концентрац. шкалой (молярная доля,молярность, моляльность). Антисимметричный выбор стандартного состояния удобен в тех случаях, когда растворенное в-во не существует в данной фазе в чистом виде (напр., НС1 не существует в виде жидкости при комнатной т-ре).
Норма́льные усло́вия — стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях, при н. у., англ. Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом практической и прикладной химии) следующим образом[1]:
§ Атмосферное давление 101325 Па = 760 мм рт. ст..
§ Температура воздуха 273,15 K = 0° C.
При нормальных условиях объём одного моля идеального газа составляет 22,413 996(39) дм³[2] (следствие из закона Авогадро), а количество молекул в 1 см³ составляет 2,6867774(47)×1019[3] (постоянная Лошмидта).
Стандартные условия (англ. Standard Ambient Temperature and Pressure, SATP):
§ давление 1 Бар = 105 Па = 750,06 мм рт. ст.;
§ температура 298,15 К = 25 °С.
28 вопрос
А́том (от др.-греч. ἄτομος — неделимый) — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств[1]. Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонови незаряженных нейтронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
| Содержание [убрать] · 1 История становления понятия · 2 Модели атомов · 3 Квантово-механическая модель атома · 4 Строение o 4.1 Субатомные частицы o 4.2 Электроны в атоме · 5 Свойства o 5.1 Масса o 5.2 Размер o 5.3 Радиоактивный распад o 5.4 Магнитный момент o 5.5 Энергетические уровни o 5.6 Валентность · 6 См. также · 7 Примечания · 8 Литература · 9 Ссылки |
[править]История становления понятия
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см.: атомизм). В XVII иXVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является «неделимым».
На международном съезде химиков в г. Карлсруэ (Германия) в 1860 г. были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
[править]Модели атомов
§ Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов[2].
§ Модель атома Томсона (модель «Пудинг с изюмом», англ. Plum pudding model). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
§ Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
§ Планетарная модель атома Бора-Резерфорда. В 1911 году[3] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобиепланетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
[править]Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряданейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяетсяэлектрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
[править]Строение
[править]Субатомные частицы
Основная статья: Субатомные частицы
Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11×10−31 кг, отрицательным зарядом и размером, слишком малым для измерения современными методами.[4] Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726×10−27 кг). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929×10−27 кг).[5] При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5×10−15 м, хотя размеры этих частиц определены плохо.[6]
В стандартной модели элементарных частиц как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами. Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный +2⁄3 или −1⁄3 элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон — из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и зарядах протона и нейтрона. Кварки связаны между собой сильными ядерными взаимодействиями, которые передаются глюонами.[7][8]
[править]Электроны в атоме
Основная статья: Атомная орбиталь
При описании электронов в атоме в рамках квантовой механики, обычно рассматривают распределение вероятности в 3n-мерном пространстве для системы n электронов.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электронам, как и другим частицам, свойственен корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по орбитали, что неверно. Состояние электронов описывается волновой функцией, квадрат модуля которой характеризует плотность вероятности нахождения частиц в данной точке пространства в данный момент времени, или, в общем случае, оператором плотности. Существует дискретный набор атомных орбиталей, которым соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии. Электрон может перейти на уровень с большей энергией, поглотив фотон. При этом он окажется в новом квантовом состоянии с большей энергией. Аналогично, он может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при этом будет равна разности энергий электрона на этих уровнях (см.: постулаты Бора).
[править]Свойства
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий).[9] Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов.[10] Все изотопы элементов периодической системы, начиная с номера 83 (висмут), радиоактивны.[11][12]
[править]Масса
Основная статья: Атомная масса
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, полное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66×10−24 г.[13] Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м.[14] Масса атома приблизительно равна произведению массового числа на атомную единицу массы.[15] Самый тяжёлый стабильный изотоп — свинец-208[11] с массой 207,9766521 а. е. м.[16]
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли. В одном моле любого вещества по определению содержится одно и то же число атомов (примерно 6,022×1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.[13]
[править]Размер
Основная статья: Радиус атома
Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры определяются по расстоянию между ядрами соседних атомов, которые образовали химическую связь (Ковалентный радиус) или по расстоянию до самой дальней из стабильных орбит электронов в электронной оболочке этого атома (Радиус атома). Радиус зависит от положения атома в периодической системе, вида химической связи, числа ближайших атомов (координационного числа) и квантово-механического свойства, известного какспин.[17] В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо.[18]Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия (225 пм).[19] Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм), поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода.[20] Одна капля воды содержит 2 секстиллиона(2×1021) атомов кислорода, и в два раза больше атомов водорода.[21] Один карат алмаза с массой 0,2 г состоит из 10 секстиллионов атомов углерода.[22] Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока.[23]
Учёные из Харьковского физико-технического института представили первые в истории науки снимки атома. Для получения снимков учёные использовали электронный микроскоп, фиксирующий излучения и поля (field-emission electron microscope, FEEM). Физики последовательно разместили десятки атомов углерода в вакуумной камере и пропустили через них электрический разряд в 425 вольт. Излучение последнего атома в цепочке на фосфорный экран позволило получить изображение облака электронов вокруг ядра.[24]
[править]Радиоактивный распад
Основная статья: Радиоактивный распад


Диаграмма времени полураспада (T½) в секундах для различных изотопов с Z протонами и N нейтронами.
У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подверженырадиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий (расстояний порядка 1 фм[25]).
Существуют три основные формы радиоактивного распада:[26][27]
§ Альфа-распад происходит, когда ядро испускает альфа-частицу — ядро атома гелия, состоящее из двух протонов и двух нейтронов. В результате испускания этой частицы возникает элемент с меньшим на два атомным номером.
§ Бета-распад происходит из-за слабых взаимодействий, и в результате нейтрон превращается в протон или наоборот. В первом случае происходит испускание электрона и антинейтрино, во втором — испускание позитрона и нейтрино. Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу.
§ Гамма-излучение происходит из-за перехода ядра в состояние с более низкой энергией с испусканием электромагнитного излучения. Гамма-излучение может происходить вслед за испусканием альфа- или бета-частицы после радиоактивного распада.
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Это экспоненциальный распад, который вдвое уменьшает количество оставшихся ядер за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа.[25]
[править]Магнитный момент
Основные статьи: Электронный магнитный дипольный момент, Ядерный магнитный момент
Элементарные частицы обладают внутренним квантовомеханическим свойством известным как спин. Оно аналогичноугловому моменту объекта вращающегося вокруг собственного центра масс, хотя строго говоря, эти частицы являются точечными и нельзя говорить об их вращении. Спин измеряют в единицах приведённой планковской постоянной ( ), тогда электроны, протоны и нейтроны имеют спин равный ½
), тогда электроны, протоны и нейтроны имеют спин равный ½  . В атоме электроны обращаются вокруг ядра и обладают орбитальным угловым моментом помимо спина, в то время как ядро само по себе имеет угловой момент благодаря ядерному спину.[28]
. В атоме электроны обращаются вокруг ядра и обладают орбитальным угловым моментом помимо спина, в то время как ядро само по себе имеет угловой момент благодаря ядерному спину.[28]
Магнитное поле, создаваемое магнитным моментом атома, определяется этими различными формами углового момента, как и в классической физике вращающиеся заряженные объекты создают магнитное поле. Однако, наиболее значительный вклад происходит от спина. Благодаря свойству электрона, как и всех фермионов, подчинятьсяправилу запрета Паули, по которому два электрона не могут находиться в одном и том же квантовом состоянии, связанные электроны спариваются друг с другом, и один из электронов находится в состоянии со спином вверх, а другой — с противоположной проекцией спина — состояние со спином вниз. Таким образом магнитные моменты электронов сокращаются, уменьшая полный магнитный дипольный момент системы до нуля в некоторых атомах с чётным числом электронов.[29]
В ферромагнитных элементах, таких как железо, нечётное число электронов приводит к появлению неспаренного электрона и к ненулевому полному магнитному моменту. Орбитали соседних атомов перекрываются, и наименьшее энергетическое состояние достигается, когда все спины неспаренных электронов принимают одну ориентацию, процесс известный как обменное взаимодействие. Когда магнитные моменты ферромагнитных атомов выравниваются, материал может создавать измеримое макроскопическое магнитное поле. Парамагнитные материалы состоят из атомов, магнитные моменты которых разориентированы в отсутствии магнитного поля, но магнитные моменты отдельных атомов выравниваются при приложении магнитного поля.[29][30]
Ядро атома тоже может обладать ненулевым полным спином. Обычно при термодинамическом равновесии спины ядер ориентированы случайным образом. Однако, для некоторых элементов (таких как ксенон-129) возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами —состояния называемого гиперполяризацией. Это состояние имеет важное прикладное значение в магнитно-резонансной томографии.[31][32]
[править]Энергетические уровни
Основные статьи: Энергетический уровень, атомная спектральная линия
Когда электрон находится в связанном состоянии в атоме, он обладает потенциальной энергией, которая обратно пропорциональна его расстоянию от ядра. Эта энергия обычно измеряется в электронвольтах (эВ) и равна энергии, которую надо передать электрону, чтобы сделать его свободным (оторвать от атома). Согласно квантовомеханической модели атома связанный электрон может занимать только дискретный набор разрешённых энергетических уровней — состояний с определённой энергией. Наинизшее из разрешённых энергетических состояний называется основным, а все остальные — возбуждёнными.[33]
Для перехода электрона с одного энергетического уровня на другой нужно передать ему или отнять у него энергию. Это происходит путём соответственно поглощения или испускания фотона, причём энергия этого фотона равна абсолютной величине разности энергий начального и конечного уровней электрона. Энергия испущенного фотона пропорциональна его частоте, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра.[34] Каждый элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов.[35]


Пример линейного спектра поглощения
Когда излучение с непрерывным спектром проходит через вещество (например, газ или плазму), некоторые фотоны поглощаются атомами или ионами, вызывая электронные переходы между энергетическим состояниями, разность энергий которых равна энергии поглощённого фотона. Затем эти возбуждённые электроны спонтанно переходят на уровень, лежащий ниже по энергии, снова испуская фотоны. Таким образом, вещество ведёт себя как фильтр, превращая исходный непрерывный спектр в спектр поглощения, в котором имеются серии тёмных полос. При наблюдении с тех углов, куда не направлено исходное излучение, можно заметить излучение с эмиссионным спектром, испускаемое атомами. Спектроскопические измерения энергии, амплитуды и ширины спектральных линий излучения позволяют определить вид излучающего вещества и физические условия в нём.[36]
Более детальный анализ спектральных линий показал, что некоторые из них обладают тонкой структурой, то есть расщеплены на несколько близких линий. В узком смысле «тонкой структурой» спектральных линий принято называть их расщепление, происходящее из-за спин-орбитального взаимодействия между спином и вращательным движением электрона.[37]
Взаимодействие магнитных моментов электрона и ядра приводит к сверхтонкому расщеплению спектральных линий, которое, как правило, меньше, чем тонкое.
Если поместить атом во внешнее магнитное поле, то также можно заметить расщепление спектральных линий на две, три и более компонент — это явление называетсяэффектом Зеемана. Он вызван взаимодействием внешнего магнитного поля с магнитным моментом атома, при этом в зависимости от взаимной ориентации момента атома и магнитного поля энергия данного уровня может увеличиться или уменьшиться. При переходе атома из одного расщеплённого состояния в другое будет излучаться фотон с частотой, отличной от частоты фотона при таком же переходе в отсутствие магнитного поля. Если спектральная линия при помещении атома в магнитное поле расщепляется на три линии, то такой эффект Зеемана называется нормальным (простым). Гораздо чаще в слабом магнитном поле наблюдается аномальный (сложный) эффект Зеемана, когда происходит расщепление на 2, 4 или более линий (аномальный эффект происходит из-за наличия спина у электронов). При увеличении магнитного поля вид расщепления упрощается, и аномальный эффект Зеемана переходит в нормальный (эффект Пашена-Бака).[38] Присутствие электрического поля также может вызвать сравнимый по величине сдвиг спектральных линий, вызванный изменением энергетических уровней. Это явление известно как эффект Штарка.[39]
Если электрон находится в возбуждённом состоянии, то взаимодействие с фотоном определённой энергии может вызвать вынужденное излучение дополнительного фотона с такой же энергией — для этого должен существовать более низкий уровень, на который возможен переход, и разность энергий уровней должна равняться энергии фотона. При вынужденном излучении эти два фотона будут двигаться в одном направлении и иметь одинаковую фазу. Это свойство используется в лазерах, которые могут испускать когерентный пучок света в узком диапазоне частот.[40]
[править]Валентность
Основная статья: Валентность
Внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой, а электроны этой оболочки называются валентными электронами. Число валентных электронов определяет то, как атом связывается с другими атомами посредством химической связи. Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки.[41]
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы (таблицы Менделеева). Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными или благородными газами.[42][43]
Один из фактов субатомного мира заключается в том, что его объекты — такие как электроны или фотоны — совсем не похожи на привычные объекты макромира. Они ведут себя и не как частицы, и не как волны, а как совершенно особые образования, проявляющие и волновые, и корпускулярные свойства в зависимости от обстоятельств (см. Принцип дополнительности). Одно дело — это заявить, и совсем другое — связать воедино волновые и корпускулярные аспекты поведения квантовых частиц, описав их точным уравнением. Именно это и было сделано в соотношении де Бройля.
Луи де Бройль опубликовал выведенное им соотношение в качестве составной части своей докторской диссертации в 1924 году. Казавшееся сначала сумасшедшей идей, соотношение де Бройля в корне перевернуло представления физиков-теоретиков о микромире и сыграло важнейшую роль в становлении квантовой механики. В дальнейшем карьера де Бройля сложилась весьма прозаично: до выхода на пенсию он работал профессором физики в Париже и никогда более не поднимался до головокружительных высот революционных прозрений.
Теперь кратко опишем физический смысл соотношения де Бройля: одна из физических характеристик любой частицы — ее скорость. При этом физики по ряду теоретических и практических соображений предпочитают говорить не о скорости частицы как таковой, а о ее импульсе (или количестве движения), который равен произведению скорости частицы на ее массу. Волна описывается совсем другими фундаментальными характеристиками — длиной (расстоянием между двумя соседними пиками амплитуды одного знака) или частотой (величина, обратно пропорциональная длине волны, то есть число пиков, проходящих через фиксированную точку за единицу времени). Де Бройлю же удалось сформулировать соотношение, связывающее импульс квантовой частицы р с длиной волны λ, которая ее описывает:
p = h / λ или λ = h / p
где h — постоянная Планка.
Это соотношение гласит буквально следующее: при желании можно рассматривать квантовый объект как частицу, обладающую количеством движения р; с другой стороны, ее можно рассматривать и как волну, длина которой равна λ и определяется предложенным уравнением. Иными словами, волновые и корпускулярные свойства квантовой частицы фундаментальным образом взаимосвязаны.
Соотношение де Бройля позволило объяснить одну из величайших загадок зарождающейся квантовой механики. Когда Нильс Бор предложил свою модель атома (см. Атом Бора), она включала концепцию разрешенных орбит электронов вокруг ядра, по которым они могли сколь угодно долго вращаться без потери энергии. С помощью соотношения де Бройля мы можем проиллюстрировать это понятие. Если считать электрон частицей, то, чтобы электрон оставался на своей орбите, у него должна быть одна и та же скорость (или, вернее, импульс) на любом расстоянии от ядра.
Если же считать электрон волной, то, чтобы он вписался в орбиту заданного радиуса, надо, чтобы длина окружности этой орбиты была равна целому числу длины его волны. Иными словами, окружность орбиты электрона может равняться только одной, двум, трем (и так далее) длинам его волн. В случае нецелого числа длин волны электрон просто не попадет на нужную орбиту.
Главный же физический смысл соотношения де Бройля в том, что мы всегда можем определить разрешенные импульсы (в корпускулярном представлении) или длины волн (в волновом представлении) электронов на орбитах. Для большинства орбит, однако, соотношение де Бройля показывает, что электрон (рассматриваемый как частица) с конкретным импульсом не может иметь соответствующую длину волны (в волновом представлении) такую, что он впишется в эту орбиту. И наоборот, электрон, рассматриваемый как волна определенной длины, далеко не всегда будет иметь соответствующий импульс, который позволит электрону оставаться на орбите (в корпускулярном представлении). Иными словами, для большинства орбит с конкретным радиусом либо волновое, либо корпускулярное описание покажет, что электрон не может находиться на этом расстоянии от ядра.
Однако существует небольшое количество орбит, на которых волновое и корпускулярное представление об электроне совпадают. Для этих орбит импульс, необходимый для того, чтобы электрон продолжал движение по орбите (корпускулярное описание), в точности соответствует длине волны, необходимой, чтобы электрон вписался в окружность (волновое описание). Именно эти орбиты и оказываются разрешенными в модели атома Бора, поскольку только на них корпускулярные и волновые свойства электронов не вступают в противоречие.
Мне нравится еще одна интерпретация этого принципа — философская: модель атома Бора допускает только такие состояния и орбиты электронов, при которых не важно, какую из двух ментальных категорий человек применяет для их описания. То есть, иными словами, реальный микромир устроен так, что ему нет дела до того, в каких категориях мы пытаемся его осмыслить!
Атомная орбиталь — одноэлектронная волновая функция в сферически симметричном электрическом поле атомного ядра, задающаяся главным n, орбитальным l имагнитным m квантовыми числами.
Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме; такое особое название отражает тот факт, что состояния электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
| Содержание [убрать] · 1 Квантовые числа и номенклатура орбиталей · 2 Геометрическое представление · 3 Заполнение орбиталей электронами и электронная конфигурация атома · 4 См. также · 5 Ссылки |
[править]Квантовые числа и номенклатура орбиталей

Радиальное распределение плотности вероятности для атомных орбиталей при различных n и l.
§ Главное квантовое число n может принимать любые целые положительные значения, начиная с единицы (n = 1,2,3, … ∞) и определяет общую энергию электрона на данной орбитали (энергетический уровень):

Энергия для n = ∞ соответствует энергии одноэлектронной ионизации для данного энергетического уровня.
§ Орбитальное квантовое число (называемое также азимутальным или дополнительным квантовым числом) определяет момент импульса электрона и может принимать целые значения от 0 до n — 1 (l = 0,1, …, n — 1).Момент импульса при этом задаётся соотношением
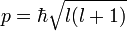
Атомные орбитали принято называть по буквенному обозначению их орбитального числа:
| Значение орбитального квантового числа | |||||
| Буквенное обозначение | s | p | d | f | g |
Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах: s (sharp) — резкая серия в атомных спектрах, p (principal)— главная, d (diffuse) — диффузная, f (fundamental) — фундаментальная.
§ Магнитное квантовое число ml определяет проекцию орбитального момента импульса на направление магнитного поля и может принимать целые значения в диапазоне от - l до l, включая 0 (ml = - l … 0 … l):
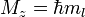
В литературе орбитали обозначают комбинацией квантовых чисел, при этом главное квантовое число обозначают цифрой, орбитальное квантовое число — соответствующей буквой (см. таблицу ниже) и магнитное квантовое число — выражением в нижнем индексе, показывающем проекцию орбитали на декартовы оси x, y, z, например 2px, 3dxy, 4fz(x²-y²). Для орбиталей внешней электронной оболочки, то есть в случае описания валентных электронов, главное квантовое число в записи орбитали, как правило, опускают.
[править]Геометрическое представление
Геометрическое представление атомной орбитали — область пространства, ограниченная поверхностью равной плотности (эквиденситной поверхностью) вероятности илизаряда. Плотность вероятности на граничной поверхности выбирают исходя из решаемой задачи, но, обычно, таким образом, чтобы вероятность нахождения электрона в ограниченной области лежала в диапазоне значений 0,9-0,99.
Поскольку энергия электрона определяется кулоновским взаимодействием и, следовательно, расстоянием от ядра, то главное квантовое число n задаёт размер орбитали.
Форма и симметрия орбитали задаются орбитальным квантовыми числами l и m: s -орбитали являются сферически симметричными, p, d и f -орбитали имеют более сложную форму, определяемую угловыми частями волновой функции — угловыми функциями. Угловые функции Ylm (φ, θ) — собственные функции оператора квадрата углового момента L², зависящие от квантовых чисел l и m, являются комплексными и описывают в сферических координатах (φ, θ) угловую зависимость вероятности нахождения электрона в центральном поле атома. Линейная комбинация этих функций определяет положение орбиталей относительно декартовых осей координат.
Для линейных комбинаций Ylm приняты следующие обозначения:
| Значение орбитального квантового числа | |||||||||
| Значение магнитного квантового числа | 
| 
| 
| 
| 
| 
| |||
| Линейная комбинация | − | − | 
| 
| − | 
| 
| 
| 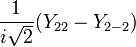
|
| Обозначение | 
| 
| 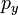
| 
| 
| 
| 
| 
| 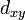
|
Дополнительным фактором, иногда учитываемым в геометрическом представлении, является знак волновой функции (фаза). Этот фактор существеннен для орбиталей с орбитальным квантовым числом l, отличным от нуля, то есть не обладающих сферической симметрией: знак волновой функции их «лепестков», лежащих по разные стороны узловой плоскости, противоположен. Знак волновой функции учитывается в методе молекулярных орбиталей МО ЛКАО (молекулярные орбитали как линейная комбинация атомных орбиталей).
[править]Заполнение орбиталей электронами и электронная конфигурация атома
На каждой орбитали может быть не более двух электронов, отличающихся значением спинового квантового числа s (спина). Этот запрет определён принципом Паули. Порядок заполнения электронами орбиталей одного уровня (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Краткую запись распределения электронов в атоме по различным электронным оболочкам атома с учётом их главного и орбитального квантовых чисел n и l называютэлектронной конфигурацией атома.
Иониза́ция — эндотермический процесс образования ионов из нейтральных атомов или молекул.
Положительно заряженный ион образуется, если электрон в атоме или молекуле получает достаточную энергию для преодоленияпотенциального барьера, равную ионизационному потенциалу. Отрицательно заряженный ион, наоборот, образуется при захвате дополнительного электрона атомом с высвобождением энергии.
Принято различать ионизацию двух типов — последовательную (классическую) и квантовую, не подчиняющуюся некоторым законамклассической физики.
| Содержание [убрать] · 1 Классическая ионизация · 2 Ионизация в электролитах · 3 Ионизация в газах · 4 Квантовая ионизация · 5 Методы ионизации · 6 См. также |
[править]Классическая ионизация
Аэроионы, кроме того, что они бывают положительными и отрицательными, разделяются на лёгкие, средние и тяжёлые ионы. В свободном виде (при атмосферном давлении) электрон существует не более, чем 10−7 — 10−8 секунды.
[править]Ионизация в электролитах
Электролиты — вещества, растворённые в воде. К электролитам относятся растворимые соли, кислоты, гидроксиды металлов. В процессе растворения атомы электролитов распадаются на катионы и анионы. Фарадей, полагаясь на данные, полученные из экспериментов с электролизом, вывел формулу о пропорциональности массы m к заряду Δq, который прошёл через электролит, или о пропорциональности массы m к силе тока I и времени Δt:  .
.
[править]Ионизация в газах
Газы по большей мере состоят из нейтральных молекул. Однако если часть молекул газов ионизируется, газ проводит электрический ток. Есть два основных способа ионизации в газах:
§ Термическая ионизация — ионизация, при которой необходимую энергию для отрыва электрона от атома дают столкновения между атомами вследствие повышения температуры;
§ Ионизация электрическим полем — ионизация вследствие повышения значения напряжения внутреннего электрического поля выше предельного значения. Из этого следует отрыв электронов от атомов газа.
[править]Квантовая ионизация
Основная статья: Фотоэффект
В 1887 году Генрих Герц установил, что под действием света из тела могут вырываться электроны — было открыто явление фотоэффекта. Это не согласовывалось с волновой теорией света — она не смогла объяснить законы фотоэффекта и наблюдаемое разделение энергии в спектре электромагнитного излучения. В 1900 году Макс Планкустановил, что тело может поглощать или испускать электромагнитную энергию только специальными порциями, квантами. Это дало теоретическую основу для объяснения явлений фотоэффекта. Чтобы объяснить явления фотоэффекта, в 1905 году Альберт Эйнштейн выдвинул гипотезу про существование фотонов как частичек света, что позволяет объяснить квантовую теорию — фотоны, которые способные поглощаться или излучаться как целое одним электроном, придают ему достаточную кинетическую энергию для преодоления силы тяготения электрона к ядру — возникает квантовая ионизация.
[править]Методы ионизации
Методы, использующиеся для ионизации проводящих материалов:
Искровая ионизация: за счёт разницы потенциалов между кусочком исследуемого материала и другим электродом возникает искра, вырывающая с поверхности мишениионы.
Ионизация в тлеющем разряде происходит в разряжённой атмосфере инертного газа (например, в аргоне) между электродом и проводящим кусочком образца.
Ударная ионизация. Если какая-либо частица с массой m (электрон, ион или нейтральная молекула), летящая со скоростью V, столкнётся с нейтральным атомом или молекулой, то кинетическая энергия летящей частицы может быть затрачена на совершение акта ионизации, если эта кинетическая энергия не меньше энергии ионизации.
30 вопрос
Гидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.
| Содержание [убрать] · 1 Гидролиз солей o 1.1 Степень гидролиза o 1.2 Константа гидролиза · 2 Гидролиз органических веществ · 3 См. также · 4 Примечания |
[править]Гидролиз солей
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей[1]:
§ 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
CO32− + H2O = HCO3− + OH−
Na2CO3 + Н2О = NaHCO3 + NaOH
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
§ 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
Cu2+ + Н2О = CuOH+ + Н+
CuCl2 + Н2О = CuOHCl + HCl
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
§ 3. Гидролиз соли слабой кислоты и слабого основания:
2Al3+ + 3S2− + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ)
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
[править]Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (c гидр/ c общ)·100 %
где c гидр — число молей гидролизованной соли, c общ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
[править]Константа гидролиза

| Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей. |
Константа гидролиза — константа равновесия гидролитической реакции.
Выведем уравнение константы гидролиза соли, образованной слабой кислотой и сильным основанием:
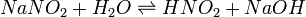

Уравнение константы равновесия для данной реакции будет иметь вид:
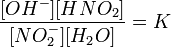 или
или 
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных 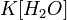 можно заменить одной новой — константой гидролиза:
можно заменить одной новой — константой гидролиза:
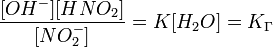
Численное значение константы гидролиза получим, используя ионное произведение воды  и константу диссоциации азотистой кислоты
и константу диссоциации азотистой кислоты  :
:


подставим в уравнение константы гидролиза равна:
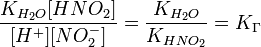
В общем случае для соли, образованной слабой кислотой и сильным основанием:
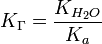 , где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе
, где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
 , где Kb — константа диссоциации слабого основания, образующегося при гидролизе
, где Kb — константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:

[править]Гидролиз органических веществ
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций катаболизма при участии ферментов. Например,в ходе гидролиза при участии пищеварительных ферментов белки расщепляются на аминокислоты, жиры — на глицерин и жирные кислоты, полисахариды (например, крахмал и целлюлоза) — намоносахариды (например, на глюкозу), нуклеиновые кислоты — на свободные нуклеотиды.
При гидролизе жиров в присутствии щёлочей получают мыло; гидролиз жиров в присутствии катализаторов применяется для получения глицерина и жирных кислот. Гидролизом древесины получают этанол, а продукты гидролиза торфа находят применение в производстве кормовых дрожжей, воска, удобрений и др.
В качестве примера возьмем гидролиз ацетата натрия:
CH3COONa+HOH<—>CH3COOH+NaOH
Ионное уравнение:
CH3COO-+HOH<—>CH3COOH+OH-
Константа равновесия этой реакции
K=[CH3COOH]•[OH-]/[CH3COO- ]•[HOH]
так как концентрация воды практически остается постоянной, ее можно объединить с константой равновесия:
Kг=K•[H2O]=[CH3COOH]•[OH-]/[CH3COO-]
где Кг - константа гидролиза.
Выразим [OH-] через ионное произведение воды [OH-] =Kв / [H+] и
подставив эту величину в уравнение Кг получаем
Kг=K•Kв =[CH3COOH]•[OH-]/[CH3COO-]•[H+] = Kв/Kk
где Kk - константа диссоциации слабой кислоты.
В общем случае, если исходную концентрацию аниона слабой кислоты А- -обозначить через С моль/л, то Ch моль/л – это концентрация той части аниона А-, которая подверглась гидролизу и образовала Ch моль/л слабой кислоты HA и Ch моль/л гидроксильных ионов:
| A- | + | HOH | <—> | HA | + | OH- |
| C-Ch | Ch | Ch |
где: h – степень гидролиза, т.е доля молекул соли, подвергающихся гидролизу.
Константа гидролиза соли:

При малом значении h: Kг=Сh2 откуда  .
.
Так как [HA]=[OH-]=C, то Kг=[OH- ]2 /C; [H+]=Kв/[OH- ]=Kв/Kк, pH=-lg[H+].
Аналогично соотношение можно получить и при рассмотрении гидролиза соли слабого основания и сильной кислоты:
Kг=[OH- ]2 /C; [H+]=Kв/[OH- ]=Kв/Kосн
Пример: Определить pH 0.02Н раствора соды Na2C03, учитывая только первую ступень гидролиза.
Решение: Гидролиз соли протекает по уравнению
Na2CO3+HOH=NaOH+NaHCO3 или CO32-+HOH=OH-+HCO3 -
Kг=Kв/Kк=10-14/4,7•10-11=2,1•10-4
Для вычисления степени гидролиза необходимо вычислить молярную концентрацию раствора
С (Na2CO3)=0,01 моль/л
 2018-01-21
2018-01-21 1670
1670