такой процесс взаимодействия между двумя веществами, при котором протекает обратимая реакция окисления одного вещества за счет восстановления другого и в среде образуется смесь окисленных и восстановленных ионов, напр. — Fe'" и Fe", Sn" и Sn'" и т. д. Уровень интенсивности окислительно-восстановительной системы определяется величиной окислительно-восстановительного потенциала Eh, которую выражают в вольтах, по отношению к потенциалу нормального водородного электрода.
Чем более положителен потенциал системы, тем более окислительными свойствами она обладает. Потенциалы, которые получаются в системах, содержащих равные концентрации окисленного и восстановленного иона, наз. нормальными.
О. о.-в. с. по величине нормальных потенциалов могут быть расположены в ряд, причем каждая система является окислителем по отношению к системе, обладающей более отрицательным нормальным потенциалом, и восстановителем по отношению к системе с более положительным нормальным потенциалом. Окислительно-восстановительные системы играют большую роль при минералообразовании, преобразовании органических веществ в осадочных породах и т. д.
44 вопрос
45 вопрос
Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катионуводорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях[1][2].
Например, в реакции:
NaOH + HCl = NaCl + H2O
эквивалентом будет реальная частица — ион Na+, в реакции
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
эквивалентом будет являться мнимая частица ½Zn(OH)2.
Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число моль вещества эквивалентное одному моль катионов водорода в рассматриваемой реакции.
| Содержание [убрать] · 1 Эквивалентная масса o 1.1 Эквивалентная молярная масса вещества o 1.2 Фактор эквивалентности o 1.3 Число эквивалентности · 2 Закон эквивалентов · 3 См. также · 4 Примечания |
[править]Эквивалентная масса
Эквивалентная масса — это масса одного эквивалента данного вещества.
[править]Эквивалентная молярная масса вещества
Молярная масса эквивалентов обычно обозначается как  или
или  . Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как
. Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как 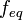 ).
).
Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Mэкв = fэкв×M
[править]Фактор эквивалентности
Отношение эквивалентной молярной массы к его собственной молярной массе называется фактором эквивалентности (обозначается обычно как 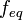 ).
).
[править]Число эквивалентности
Число эквивалентности z представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности 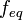 связан с числом эквивалентности z следующим соотношением:
связан с числом эквивалентности z следующим соотношением: 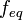 =1/z.
=1/z.
Например, в реакции:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Эквивалентом является частица ½Zn(OH)2. Число ½ есть фактор эквивалентности, z в данном случае равно 2

| вещество | реакция | |||
| простое * | сложное | ОВР (Окислительно-восстановительная реакция) | обменная | |
| X | число атомов в формульной единице | число катионов (анионов) | число атомов элемента, поменявших степень окисления | число замещенных частиц в формульной единице |
| Y | характерная валентность элемента | фиктивный заряд на катионе (анионе) | число принятых (отданных) элементом электронов | фиктивный заряд на частице |
* — для инертных газов Z = 1
Фактор эквивалентности помогает сформулировать закон эквивалентности.
[править]Закон эквивалентов
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов:
§ все вещества реагируют в эквивалентных отношениях.
§ формула, выражающая Закон эквивалентов: m1Э2=m2Э1
§ Электрохимический эквивалент — количество вещества, которое должно выделиться на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества электричества:
§ 
§ где  — постоянная Фарадея.
— постоянная Фарадея.
§ Постоя́нная Фараде́я  , — физическая постоянная, определяющая соотношение между электрохимическими и физическими свойствами вещества.
, — физическая постоянная, определяющая соотношение между электрохимическими и физическими свойствами вещества.
§ Постоянная Фарадея равна  Кл·моль−1.
Кл·моль−1.
§ Постоянная Фарадея входит в качестве константы во второй закон Фарадея (закон электролиза).
§ Численно постоянная Фарадея равна электрическому заряду, при прохождении которого через электролит на электроде выделяется (1/z) моль вещества A в формуле:

где: 
 — количество электронов, участвующих в ходе реакции.
— количество электронов, участвующих в ходе реакции.
§ Для постоянной Фарадея  справедливо следующее соотношение:
справедливо следующее соотношение:
§  ,
,
§ где  — элементарный заряд, а
— элементарный заряд, а  — число Авогадро.
— число Авогадро.
Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре. Название связано с тем, что изотопы находятся в одном и том же месте (в одной клетке) таблицы Менделеева. Химические свойства атома зависят практически только от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём) и почти не зависит от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левогоиндекса, означающего массовое число (например, 12C, 222Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий,актинон).
Пример изотопов: 168O, 178O, 188O — три стабильных изотопа кислорода.
| Содержание [убрать] · 1 Терминология · 2 История открытия изотопов · 3 Изотопы в природе · 4 Применение изотопов человеком · 5 См. также · 6 Ссылки |
[править]Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
[править]История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распадатория — радиоторий, имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Ф. Содди, стали называть изотопами.
[править]Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
[править]Применение изотопов человеком
В технологической деятельности люди научились изменять изотопный состав элементов для получения каких-либо специфических свойств материалов. Например, 235Uспособен к цепной реакции деления тепловыми нейтронами и может использоваться в качестве топлива для ядерных реакторов или ядерного оружия. Однако в природном уране лишь 0,72 % этого нуклида, тогда как цепная реакция практически осуществима лишь при содержании 235U не менее 3 %. В связи с близостью физико-химических свойств изотопов тяжёлых элементов, процедура изотопного обогащения урана является крайне сложной технологической задачей, которая доступна лишь десятку государств в мире. Во многих отраслях науки и техники (например, в радиоиммунном анализе) используются изотопные метки.
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции
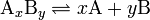
где комплекс A x B y разбивается на x единиц A и y единиц B, константа диссоциации определяется так:

где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
| Содержание [убрать] · 1 Определение · 2 Диссоциация электролитов с многовалентными ионами · 3 Связь константы диссоциации и степени диссоциации · 4 Отличие экспериментальных результатов от модели Аррениуса, вывод константы диссоциации через активности · 5 Константа диссоциации сильных электролитов · 6 Примеры расчётов o 6.1 Диссоциация воды o 6.2 Диссоциация слабой кислоты · 7 См. также |
[править]Определение
Электролитическая диссоциация слабых электролитов, согласно теории Аррениуса, является обратимой реакцией, то есть схематически её можно представить уравнениями (для одновалентных ионов:):
KA ↔ K+ + A−,
где:
§ KA — недиссоциированное соединение;
§ K+ — катион;
§ A− — анион.
Константу равновесия такой реакции можно выразить уравнением:
 , , | (1) |
где:
§ [KA] — концентрация недиссоциированного соединения в растворе;
§ [K+] — концентрация катионов в растворе;
§ [A−] — концентрация анионов в растворе.
Константу равновесия применительно к реакции диссоциации называют константой диссоциации.
[править]Диссоциация электролитов с многовалентными ионами
В случае диссоциации электролитов с многовалентными ионами, диссоциация происходит по ступеням, причём для каждой ступени существует собственное значение константы диссоциации.
Пример: Диссоциация многоосновной (борной) кислоты[ источник не указан 332 дня ]:
I стадия: H3BO3 ↔ H+ + H2BO3−,
II стадия: H2BO3− ↔ H+ + HBO32−,
III стадия: HBO32− ↔ H+ + BO33−,



Первая степень диссоциации для таких электролитов всегда много больше последующих, что означает, что диссоциация таких соединений идёт главным образом по первой стадии.
[править]Связь константы диссоциации и степени диссоциации
Исходя из определения степени диссоциации, для электролита КА в реакции диссоциации [A−] = [K+] = α·c, [KA] = c — α·c = c·(1 — α), где α — степени диссоциацииэлектролита.
Тогда:
 , , | (2) |
Это выражение называют законом разбавления Оствальда. При очень малых α (α<<1) K=cα² и
 ,
,
таким образом, при увеличении концентрации электролита степень диссоциации уменьшается, при уменьшении — возрастает. Подробнее связь константы диссоциации и степени диссоциации описана в статье Закон разбавления Оствальда.
[править]Отличие экспериментальных результатов от модели Аррениуса, вывод константы диссоциации через активности
Вышеприведённые выкладки базируются на теории Аррениуса, которая является слишком грубой, не учитывающей факторы электростатического взаимодействия ионов. Отклонения от идеального состояния в растворах электролитов возникают при очень малых концентрациях, так как межионные силы обратно пропорциональны квадрату расстояния между центрами ионов, в то время как межмолекулярные силы обратно пропорциональны седьмой степени расстояния, то есть межионные силы даже в разведённых растворах оказываются намного больше межмолекулярных.
Льюис показал, что для реальных растворов можно сохранить простые уравнения (см. выше), если вместо концентраций ионов вводить её функцию, так называемую активность. Активность (a) соотносится с концентрацией (c) через поправочный коэффициент γ, называемый коэффициентом активности:
a = γ c
Таким образом, выражение для константы равновесия, по Аррениусу описываемое уравнением (1), по Льюису будет выглядеть:
 ,
,
где
§  ;
;
§  ;
;
§  .
.
В теории Льюиса связь между константой и степенью диссоциации (в теории Аррениуса записываемая уравнением (2) выражается соотношением:

Если никаких других влияний, отклоняющих раствор от идеального состояния нет, то недиссоциированные молекулы ведут себя как идеальные газы и γKA = 1, а истинное выражение закона разбавления Оствальда примет вид:
 ,
,
где
§  — средний коэффициент активности электролита.
— средний коэффициент активности электролита.
При c→0 и γ→1 вышеприведённое уравнение закона разбавления Оствальда принимает вид (2). Чем сильнее диссоциирует электролит, тем быстрее значение коэффициента активности γ отклоняется от единицы, и тем быстрее наступает нарушение классического закона разведения.
[править]Константа диссоциации сильных электролитов
Сильные электролиты диссоциируют практически нацело (реакция необратимая), поэтому в знаменателе выражения для константы диссоциации стоит ноль, и всё выражение стремится к бесконечности. Таким образом, для сильных электролитов термин «константа диссоциации» лишён смысла.
[править]Примеры расчётов
[править]Диссоциация воды
Вода представляет собой слабый электролит, диссоциирующий в соответствии с уравнением

Константа диссоциации воды при 25 °C составляет

Считая, что в большинстве растворов вода находится в молекулярном виде (концентрация ионов H+ и OH− мала), и учитывая, что молярная масса воды составляет 18,0153 г/моль, а плотность при температуре 25 °C — 997,07 г/л, чистой воде соответствует концентрация [H2O] = 55,346 моль/л. Поэтому предыдущее уравнение можно переписать в виде

Эта величина называется ионным произведением воды. Так как для чистой воды [H+] = [OH−], можно записать

Водородный показатель воды, таким образом, равен

[править]Диссоциация слабой кислоты
Найдём pH и степень диссоциации 0,01M раствора плавиковой кислоты HF. Её константа диссоциации равна
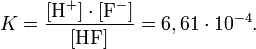
Обозначим степень диссоциации через α. Тогда [H+] = [F−] = Cα, [HF] = C(1-α). Подставив эти выражения в формулу для константы диссоциации, получим

Откуда следует квадратное уравнение относительно α:

Решая его по стандартной формуле, получим

Применение приближённой формулы даёт ошибку около 15 %:

Исходя из найденного значения степени диссоциации найдём pH раствора:

Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации α равна отношению числа диссоциированных молекул n к сумме n + N, где N — число недиссоциированных молекул. Часто α выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
[править]Пример
Для уксусной кислоты CH3COOH величина α равна 4% (в 0,01М растворе). Это значит, что в водном растворе кислоты лишь 4 из каждых 100 молекул диссоциированы, то есть находятся в виде ионов Н+ и СН3СОО−, остальные же 96 молекул не диссоциированы.
[править]Методы определения
§ по электропроводности раствора
§ по понижению температуры замерзания
[править]Мнимая степень диссоциации
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать для них изотонический коэффициент, равный количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент всегда меньше определённого по формуле. Например, изотонический коэффициент для 0,05-моляльного раствора NaCl равен 1,9 вместо 2,0, (для раствора сульфата магния той же концентрации и вовсе i = 1,3). Это объясняеттеория сильных электролитов, разработанная в 1923 году П. Дебаем и Э. Хюккелем: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные притягиваются, а одноимённо заряженные — отталкиваются; силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводностирастворов λ, которая возрастает с разбавлением раствора. Через отношение реальной электропроводности к таковой при бесконечном разбавлении определяют мнимую степень диссоциации сильных электролитов, также обозначаемую через α:
 ,
,
где nimg — мнимое, а ndisslv. — реальное количество частиц в растворе.
 2018-01-21
2018-01-21 2467
2467
