Вода - слабый электролит. Из 107 молекул воды диссоциирует на ионы только 1 молекул
 .
.
Напишем выражение для константы диссоциации воды
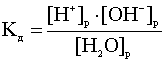 .
.
Принимая равновесную концентрацию воды константой, получаем:
 - ионное произведение воды (новая константа).
- ионное произведение воды (новая константа).
Отсюда получаем:
 .
.
При комнатной температуре 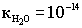 .
.
 .
.
В воде, т.е. в нейтральной среде, концентрация ионов водорода равна концентрации ионов гидроксида и равна 10-7 моль/дм3.
Физический смысл ионного произведения воды заключается в том, что оно справедливо не только для чистой воды, но и для растворов кислот, гидроксидов, солей.
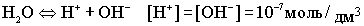 - нейтрльная среда
- нейтрльная среда
В H2O ввели кислоту, то есть Н+
[H+]>[OH- ]
 - кислая среда
- кислая среда

Если добавить к воде гидроксид, т.е. OH-, то [H+]<[OH- ].
 - щелочная среда.
- щелочная среда.
Чтобы избавится от отрицательной степени, для характеристики среды введено понятие водородный показатель PH.
PH = -lg[H+]
| PH < 7- Кислая среда PH =7 - Нейтральная среда PH >7 - Щелочная среда | 
|
Характер среды, то есть PH среды, определяют различными методами. Самое точное определение с помощью PH - метра. Наиболее простые методы измерения РН с помощью индикаторов. У жидких индикаторов есть свои интервалы измерения РН. Наиболее универсальным из индикаторов является лакмус.
Равновесие в насыщенных растворах малорастворимых электролитов. Произведение
 2018-01-21
2018-01-21 1062
1062








