Сильные электролиты диссоциируют полностью, необратимо: AB = A+ + B-.
Истинная степень диссоциации сильных электролитов равна всегда 100 % (1,0 доли ед.).
В растворах сильных электролитов ионов очень много. Отсюда две особенности растворов сильных электролитов: расстояния между ионами очень малы; количество ионов электролита соизмеримо с количеством молекул воды, и поэтому не все ионы могут быть гидратированы молекулами воды.
В силу двух особенностей каждый ион в растворе сильного электролита окружён ионами противоположного заряда, так называемой, " ионной атмосферой ".
Ионная атмосфера приводит к тому, что между ионами разных зарядов возникают силы притяжения, а между ионами одного заряда - силы отталкивания. Поскольку все ионы равноценны, то любой из них можно считать центральным в его ближайшем окружении, то – есть ионной атмосфере.
Понятием ионной атмосферы объясняют поведение ионов в растворе сильных электролитов. В растворах сильных электролитов ионы мешают друг другу принимать участие в физ и хим процессах. Кажущаяся степень диссоциации (αкаж.) отражает то количество активных ионов, которые принимают участие в химических и физических процессах. Поэтому αкаж. всегда меньше 100 % (1,0).
Под активностью понимается та часть ионов, которая приняла участие в физических и химических процессах, то - есть понятно, что активность всегда меньше концентрации. Поэтому αкаж< αист.
Активность и концентрация связаны между собой коэффициентом активности γ a = γ .c.
Коэффициент активности - отношение экспериментальной величины к теоретической: γ = экспериментальная величина/теоретическая величина.
активности близка к единице, поэтому для разбавленных растворов сильных электролитов можно пользоваться понятием концентрации.
Если же растворы концентрированные, приходится пользоваться понятием активности. Коэффициент активности раствора электролитов равен средней геометрической величине активности образовавших его ионов. Так, для электролитов An Bm:
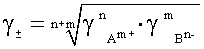 .
.
Кажущаяся степень диссоциации учитывает активные ионы, принявшие участие в процессах.
Истинная степень диссоциации сильных электролитов всегда равна 1,0, кажущаяся степень диссоциации возрастает с повышением температуры раствора и понижением концентрации раствора.
Кажущаяся степень диссоциации связана с изотоническим коэффициентом αкаж. = i-1 / n-1, где
n - количество ионов, на которые диссоциирует данный электролит.
 2018-01-21
2018-01-21 541
541








